时间:2017-07-10 17:40:16
1、选择题 下列物质与氢氧化钠溶液反应,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色的是
A. NH3
B.FeCl3溶液
C. FeCl2溶液
D. NaHCO3溶液
2、选择题 甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。 下列说法正确的是
下列说法正确的是
A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
B.若甲为金属单质,乙为非金属单质,则甲只能是Mg
C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
3、计算题 (6分)现有一种铜和铁的混合物样品。为测定该样品中铁的含量,某学生取10.0 g此样品置于烧瓶中,将80.0 mL稀硫酸分四次加入烧瓶并做相关记录。
有关数据记录如下表:
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 7.20 |
| 2 | 20.0 | 4.40 |
| 3 | 20.0 | 2.00 |
| 4 | 20.0 | 2.00 |
4、选择题 将1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672ml气体(标准状况),将盛有此气体的容器倒扣在水中,通入少量氧气,最后剩余气体224ml(标准状况)。则通入的氧气在标准状况下的体积为
A.504ml
B.168ml
C.336ml
D.224ml
5、填空题 (14分)铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu
上述两种方法中,铜元素均被?(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: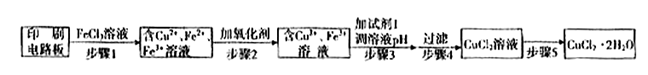 ①证明步骤I所加FeCl3溶液过量的方法是?。
①证明步骤I所加FeCl3溶液过量的方法是?。
②步骤2中所加的氧化剂最适宜的是?。
A.HNO3? B.H2O2? C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是?。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是?(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)===CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O2(l)==2H2O(l)+O2(g)?△H2=-196kJ/mol
H2(g)+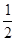 O2(g)==H2O(l)?△H3=-286kJ/mol
O2(g)==H2O(l)?△H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)的△H=?。
(3)欲实现反应Cu+H2SO2==CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)