时间:2017-03-05 14:39:42
1、实验题 碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平) 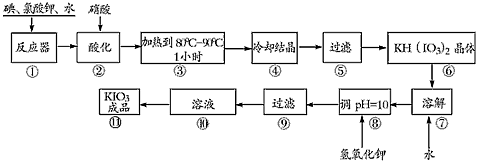
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式:_____________________________。若有1 mol I2完全反应,则该反应中转移电子的数目为________(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤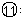 得到碘酸钾晶体,你建议的方法是__________
得到碘酸钾晶体,你建议的方法是__________
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:_______________________________________。
2、实验题 碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(1)判断碘是否已完全反应的实验方法是______________;
(2)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,最好采取的措施是_____________;
(3)测定产品中NaI含量的方法是:a.称取3.000 g样品、溶解,在250 mL容量瓶中定容; b.量取25.00 mL待测溶液于锥形瓶中;c.用0.1000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
① 上述测定过程所需仪器中,需要检查是否漏液的仪器有__________________。
② 上述样品中NaI的质量分数为_______________ 。
③ 若用上述方法测定产品中NaI的质量分数偏低(测定过程中产生的误差忽略不计),其可能原因有_____________________________
3、填空题 (1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体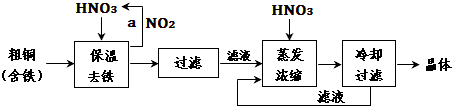
①在步骤a中,还需要通入氧气和水,其目的是_____________________。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在_________范围。 
不用加水的方法调节溶液pH的原因是__________。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)__________。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是____________________。
(3)在硝酸铜溶液中,各种离子浓度由大到小的顺序是__________。
4、填空题 氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
Ⅰ工业上有多种方法来制备氮化硅,常见的方法有:
方法一直接氮化法:在1 300-l 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为__________:
方法二化学气相沉积法:在高温条件下利用四氯化硅气体、纯氯气、氢气反应生成氯化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是____________________。
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体________(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为____________。
Ⅱ.(1)氨化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氨化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有____________。
(2)已知:25℃,101 kPa条件下的热化学方程式:
3Si(s)+2N2(g)=Si3N4(s);△H= -750.2kJ/mol
Si(s)+2Cl2(g)=SiCl4(g);△H=-609.6 kJ/mol
H2(g)+Cl2(g)=HCl(g);△H=-92.3 kJ/mol
请写出四氯化硅气体与氮气、氢气反应的热化学方程式:____________________。
Ⅲ.工业L制取高纯硅和四氯化硅的生产流程如下: 
已知:X,高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。 (1)原料B的主要成分是____________。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:____________________
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu?___________(填“能”或“不能”)。写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极:___________________;阴极:_____________________
5、填空题 为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: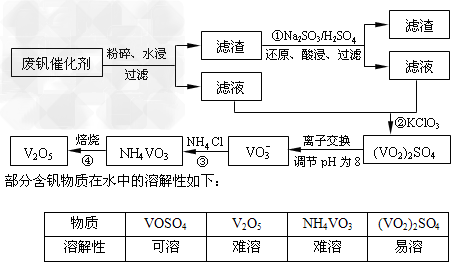
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为_____________。
(2)滤液中含钒的主要成分为______________(填化学式)。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式?______________;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为___________、_________℃。 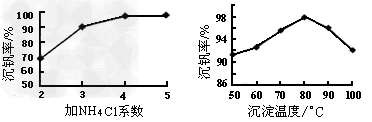
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+?=?2VOn+?+?2CO2↑+?mH2O,其中n、m分别为______________、________?。
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++?V2++?2H+ VO2++H2O+V3+,电池放电时正极的电极反应式为___________。
VO2++H2O+V3+,电池放电时正极的电极反应式为___________。