时间:2017-03-05 14:39:42
1、填空题 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下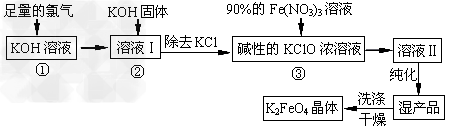
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH?与Cl2反应的化学方程式____________________,该反应的氧化产物是___________。? ?
(2)在溶液I中加入KOH固体的目的是_________?(填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为?KClO ?
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________________。 ?
(4)如何判断K2FeO4晶体已经洗涤干净_________________。 ?
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:___FeO42-+?___H2O?=?___Fe(OH)3(胶体)+?___O2↑+?___OH-?。
2、填空题 工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料--铁红(Fe2O3)和回收
(NH4)2SO4,具体生产流程如下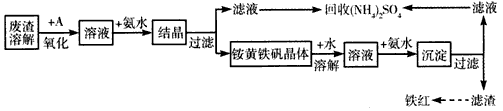
注:铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12
(1)在废渣溶解操作时,应选用_______溶解(填字母)
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2)物质A是一种氧化剂,工业上最好选用___________(供选择使用的有:空气、Cl2、MnO2),其理由是_________________。
(3)根据下图有关数据,你认为工业上氧化操作时应控制的条件是__________。 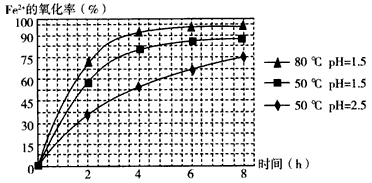
(4)“结晶”反应的化学方程式为____________________。
(5)简述检验“滤液”中含有NH4+的实验方法:______________________________。
3、填空题 工业上生产高氯酸(沸点:90℃)时还同时生产了亚氯酸钠,其工艺流程如下:? 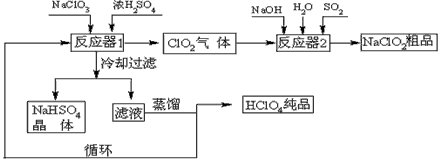
(1)冷却过滤的目的是降低NaHSO4的_________并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为___________。SO2的作用是作___________剂。
(3)循环使用的物质是_____________。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是_____________。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)________________。
4、选择题 下列物质的制备,符合工业生产实际的是
[? ]
A.将氯气通入澄清石灰水中制漂白粉
B.用离子交换膜法电解饱和食盐水制备烧碱、氢气和氯气
C.将氢气和氯气混合后点燃,产物用水吸收制备盐酸
D.将SO2和O2的混合气加高压后,通过接触室,制备SO3
5、填空题 碳酸锂广泛应用于陶瓷和医药等领域。以β-锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备Li2CO3 的工艺流程如下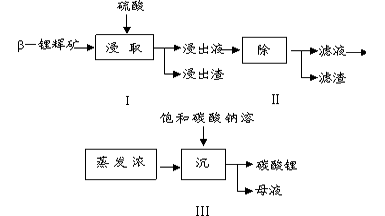
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;
Li2SO4、LiOH和 Li2CO3在303K下的溶解度分别为34.2 g、12. 7 g和1.3 g。
(1)步骤I前,β-锂辉石要粉碎成细颗粒的目的是________________。
(2)步骤I中,酸浸后得到的酸性溶液中含有Li+、SO42-,另外还含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、
Na+等杂质,需在搅拌下加入____(填“石灰石”“氯化钙”或“稀硫酸”)以调节溶液的pH到
6.0-6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有
____________。
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________________。
(5)从母液中可回收的主要物质是___________。