时间:2017-03-05 14:39:42
1、填空题 工业上用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,需把浓硝酸用等体积的水稀释。试简要回答下列问题:
(1)用稀硝酸而不用浓硝酸的原因是___
(2)从经济效益和环境保护角度考虑,设计制取硝酸铜最适宜的方法,用化学方程式表示为____
参考答案:(1)用稀硝酸消耗原料较少,且产生污染物较少
(2)2Cu+O2=2CuO,CuO+2HNO3= Cu(NO3)2+H2O
本题解析:
本题难度:一般
2、选择题 工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细小的空气泡。有关该制备方法的叙述中,不正确的是
[? ]
A.该方法应用了原电池工作原理
B.该方法不产生污染大气的二氧化硫
C.该方法提高了硫酸的利用率
D.该方法提高了铜的利用率
参考答案:D
本题解析:
本题难度:简单
3、填空题 二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下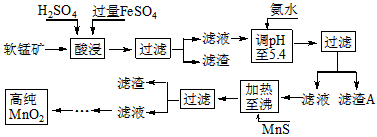
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为
_________________________。
(2)滤渣A的主要成分是_____________________________。
(3)加入MnS的目的是除去______________________杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为___________________________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有____________________________(写两种)。
参考答案:(1)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3
(3)Cu2+、Zn2+
(4)MnO2+H2O+e-=MnO(OH)+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-)
(5)锌、二氧化锰
本题解析:
本题难度:一般
4、填空题 工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料--铁红(Fe2O3)和回收
(NH4)2SO4,具体生产流程如下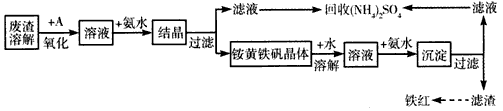
注:铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12
(1)在废渣溶解操作时,应选用_______溶解(填字母)
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2)物质A是一种氧化剂,工业上最好选用___________(供选择使用的有:空气、Cl2、MnO2),其理由是_________________。
(3)根据下图有关数据,你认为工业上氧化操作时应控制的条件是__________。 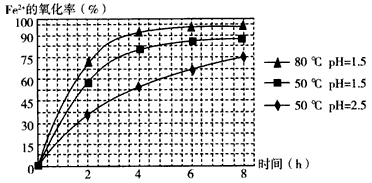
(4)“结晶”反应的化学方程式为____________________。
(5)简述检验“滤液”中含有NH4+的实验方法:______________________________。
参考答案:(1)D
(2)空气;原料来源丰富,成本低,不产生污染,不引入杂质
(3)溶液温度控制在80℃,pH控制在1.5,氧化时间为4h左右
(4)3Fe2(SO4)3+12NH3·H2O=(NH4)2Fe6(SO4)4(OH)12↓+5(NH4)2SO4
(5)取少量滤液于试管中,向试管中加入足量的浓氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口处,若红色石蕊试纸变蓝色,则说明滤液中含有NH4+
本题解析:
本题难度:一般
5、 填空题 制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2
II.对I中所得到的溶液按下列步骤进行提纯?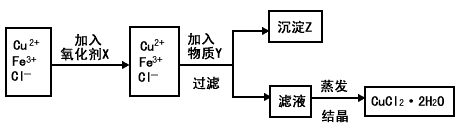

试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是____________ 。(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是_____________
②写出沉淀Z在水中的沉淀溶解平衡方程式:_______________
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2·2H2O),应采取的措施是__________ 。
(4)①某同学利用反应:Cu+2H+===Cu2+ +H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 _____________。(填“原电池”或“电解池”)
②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。 
(5)已知一些难溶物的浓度积常数如下表:某工业废水中含有Cu2+ 、Pb2+ 、Hg2+ ,最适宜向此工业废水中加入过量的___________除去它们。(选填序号)
①NaOH ②FeS ③Na2S 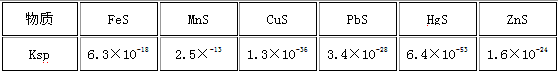
参考答案:(1)C
(2)①CuO或Cu(OH)2或CuCO3? ;
②Fe(OH)3(s)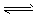 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)
(3)在HCl气流下加热浓缩,冷却结晶
(4)①电解池
②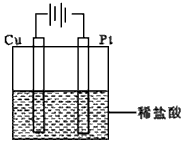
(5)②
本题解析:
本题难度:一般