时间:2017-03-03 00:07:01
1、选择题 下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO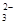 )+c(HCO
)+c(HCO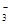 )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A.①④
B.②⑤
C.①③
D.②④
2、选择题 下列各反应的化学方程式中,属于水解反应的是
A.HCO3— + H2O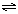 CO32—+ H3O+
CO32—+ H3O+
B.H2O + H2O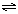 OH— + H3O+
OH— + H3O+
C.CO2 + H2O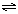 H2CO3
H2CO3
D.CO32— +H2O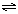 HCO3— + OH—
HCO3— + OH—
3、选择题 常温下,向一定浓度的醋酸溶液中逐滴加入氢氧化钠溶液直至过量,在此操作过程中,有关溶液中离子浓度变化的大小关系不正确的是
A.当pH=7时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
B.当pH>7时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.当恰好完全中和时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.反应全程都有关系:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
4、选择题 下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
5、简答题 写出下列盐水解的离子方程式:
①CH3COONa______
②(NH4)2SO4______
③NaHCO3______.