时间:2017-03-02 23:43:16
1、选择题 设NA为阿伏加德罗常数的数值,下列叙述中正确的是?
A.3.4gNH3中含有电子数为0.2NA
B.标准状况下,22.4 L Cl2参加所有化学反应转移的电子数一定都是2NA
C.标准状况下,0.5NA个SO3分子所占的体积约为11.2 L
D.在18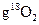 中含有
中含有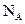 个氧原子
个氧原子
参考答案:D
本题解析:略
本题难度:一般
2、填空题 标准状况下,336 L的NH3溶于1L水中,所得溶液的溶质质量分数为______________,若该溶液的密度为ag/cm3,则其物质的量浓度为____________________。将上述氨水全部转化为NH4Cl,所需4 mol/L的盐酸的体积为________________________。
参考答案:20.32%;11.95a mol/L;3.75 L
本题解析:
本题难度:一般
3、选择题 标准状况下,ag气体A和bg气体B的分子数相同,下列说法不正确的是
A.气体A和B的相对分子质量之比为 a:b
B.同质量的气体A和B所含分子数目之比为b:a
C.标准状况下,气体A和B的密度之比为b:a
D.相同条件下,等体积的气体A和B的质量之比为a:b
参考答案:C
本题解析:ag气体A和bg气体B的分子数相同,则它们的物质的量相等,有关系式:a/M1=b/M2,M1/M2=a/b,A对;根据公式N=n×NA=mNA/M 知道质量相同,分子数与摩尔质量成反比,故B对;ρ=m/V,A、B的分子数相等,则体积相等,密度之比等于质量之比,C错,选C。
考点:有关物质的量公式的转换。
本题难度:一般
4、计算题 .(12分)由等物质的量的 和
和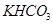 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中 与
与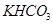 的质量分别为 和 。
的质量分别为 和 。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为  。
。
(3)如果盐酸过量,生成 的体积为 L。
的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成 的体积,还需要知道 。
的体积,还需要知道 。
(5)若 和
和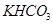 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成 的物质的量(用n表示)的范围是 。
的物质的量(用n表示)的范围是 。
参考答案:(12分,每空2分)(1)8.4 g 10 g (2)2 (3)4.48
(4)盐酸的物质的量浓度(或其他合理答案) (5)0.184<n<0.219
本题解析:(1)设二者的物质的量都是x,则84x+100x=18.400,解得x=0.1mol,所以混合物中 与
与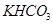 的质量分别为8.4g和10.0g。
的质量分别为8.4g和10.0g。
(2)碳酸氢盐与盐酸的方程式为H++HCO3-=H2O+CO2↑,所以消耗的盐酸是0.2mol,浓度是2.0mol/L。
(3)根据碳原子守恒可知,生成的CO2是0.2mol,标准状况下的体积是4.48L。
(4)如果盐酸不足,则要计算生成的CO2体积,还需要知道盐酸的浓度。
(5)可以采用极值法。如果全部是碳酸氢钠,则生成CO2是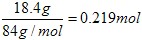 ;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。
;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。
本题难度:困难
5、填空题 实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
① ,② ,③ ,④ ,⑤ ,⑥ 。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响: ,原因是: 。
参考答案:(1)①计算 ②称量 ③溶解 ④移液 ⑤洗涤 ⑥定容
(2)500 mL容量瓶 烧杯、玻璃棒、胶头滴管
(3)偏小 溶液体积增大,溶质物质的量不变
本题解析:(1) 溶液配制步骤要记清楚;(2)配制溶液时需要的仪器要和步骤联系。如溶解用到烧杯和玻璃棒,转移溶液用到玻璃棒,定容用到胶头滴管。
(3)定容后,加盖倒转摇匀后,液面低于刻度线,是正常的,若加蒸馏水至刻度线,则溶液体积增大,而溶质的物质的量不变。所配溶液的浓度偏小。
考点:一定物质的量浓度的溶液的配制。
本题难度:一般