时间:2017-03-02 22:39:05
1、填空题 下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
| ?主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 2 ① ② ③ 3 ④ ⑤ ⑥ ⑦ ⑧ 4 ⑨ ⑩ |
2、填空题 (10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是?。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是?键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有?、?(分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是?。
a.氢化物稳定性:B>C? b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C?d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为?(用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为?。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为?,该物质的晶体属于?。
3、选择题 下列说法中正确的是
[? ]
A.双原子分子中化学键键能越大,分子越牢固
B.双原子分子中化学键键长越长,分子越牢固
C.双原子分子中化学键键角越大,分子越牢固
D.同一分子中,σ键要比π键的分子轨道重叠程度一样多,只是重叠的方向不同
4、填空题 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布?。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C?B(选填“>”“<”),第一电离能N>O,原因是?。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为?,其中硫原子采用?杂化,氧原子的价电子排布图为?,任意写出一种SO42-等电子体?。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。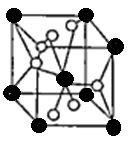
则该氧化物的化学式?(图中钛原子用“O”表示。氧原子用“O”表示)
5、选择题 下列说法正确的是
A.由C、H、O、N四种元素组成的化合物一定是离子化合物
B.ⅠA族除氢元素外的所有元素的金属性比ⅡA族元素的金属性强
C.含有最高价元素的化合物不一定具有很强的氧化性
D.化学键存在于原子之间,也存在于分子之间