时间:2017-03-02 22:39:05
1、填空题 已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出12种元素的X的数值:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | N |
| X的数值 | ? | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | ? |
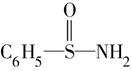 ,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。参考答案:(1)共价键?(2)元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强)原子半径越小,X的数值越大? (3)Br大于I? (4)N?
(5)第六周期第ⅠA族
本题解析:由表中数据可以看出,元素X的数值越大,元素的非金属性越强,所以可以得出,Br的X值小于Cl(2.8),故Al与Br的X值的差值小于1.7,则形成的化学键为共价键;因为N的非金属性大于C,而C和S的X值均为2.5,所以N的X值必定大于S,故S-N中,共用电子对将偏向于N原子;X值最小的元素则金属性最强的元素,为Cs,位于第六周期第Ⅰ主族。
点评:信息题是近几年高考的热点,考生在备考中应学会把握题意和分析数据,利用已学的知识点类比。
本题难度:一般
2、选择题 根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为
A.直线形 sp杂化
B.三角形 sp2杂化
C.三角锥形 sp2杂化
D.三角锥形 sp3杂化
参考答案:D
本题解析:根据价层电子对互斥理论可知,氨气分子中氮原子含有的孤对电子对数=(5-3×1)÷2=1,所以氨气是三角锥形结构,氮原子是sp3杂化,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查,主要是考查学生灵活运用价层电子对互斥理论判断分子空间构型的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
3、选择题 下列说法正确的是
[? ]
A.有些物质是由原子直接构成,如水晶、金刚石等;有些物质是由分子直接构成,如干冰、明矾等;有些物质是由离子直接构成的,如皓矾、芒硝等
B.BF3、H2O、SiCl4、PCl5四种分子中所有原子都满足最外层8电子结构
C.非金属氧化物不都是酸性氧化物;金属氧化物不都是碱性氧化物
D.尿素的熔点比醋酸的熔点高,这是由于前者比后者有更大的范德华力所致
参考答案:C
本题解析:
本题难度:简单
4、选择题 根据元素周期律和周期表,下列各项叙述正确的组合是:①同一主族元素,原子半径越大,非金属单质的熔点一定越高;②同一周期元素的原子(除稀有气体),半径越大越容易失去电子;③若R2-和M+的电子层结构相同,则微粒半径:M+>R2-;④原子半径X小于Y的同一主族的两种元素,若X(OH)n是强碱,则Y(OH)n也是强碱;⑤除第一周期外,第n周期的最后一种金属元素位于第n主族( )
A.①②④
B.①③⑤
C.②③④
D.②④⑤
参考答案:①同一主族元素,非金属单质的熔点与晶体结构有关,金属晶体族原子半径越大,金属单质的熔点越小,晶体结构相同的卤族原子半径越大,非金属单质的熔点越高,故①错误;
②同一周期元素的原子(除稀有气体)自左而右原子半径减小,金属性减弱,故半径越大越容易失去电子,故②正确;
③若R2-和M+的电子层结构相同,核电荷数R>M,核电荷数越大,离子半径越小,故微粒半径:M+<R2-,故③错误;
④原子半径X小于Y的同一主族的两种元素,原子序数Y>X,若X(OH)n是强碱,则金属性Y>X,则Y(OH)n也是强碱,故④正确;
⑤除第一周期外,当最外层电子数>周期数为非金属元素,每周期的最后一种金属元素为主族元素,且最外层电子数=周期数,故第n周期的最后一种金属元素位于第n主族,故⑤正确;
故选D.
本题解析:
本题难度:一般
5、简答题 下列说法错误的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中的共价健一定是非极性键
参考答案:A:含有共价键的化合物不一定是共价化合物,如NH4NO3等铵盐,故A错.
B:只含有共价键的化合物是共价化合物,故B对.
C:物质只要含有离子键就是离子化合物,故C对.
D:双原子单质分子形成的共价健,由于原子相同得电子能力相等,共用电子对不发生偏移,一定是非极性键,故D对.
故选A
本题解析:
本题难度:一般