时间:2017-02-07 14:54:14
1、选择题 某同学进行下列实验:在加热条件下将24gCuO、Fe2O3的混合物与充足的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40g。下列有关叙述中不正确的是(???)
A.原混合物中CuO与Fe2O3物质的量比为1:1
B.反应后所得C O2的物质的量为0.4mol
O2的物质的量为0.4mol
C.实验过程中需要的CO 质量为11.2g
D.原混合物中CuO与Fe2O3的质量比为1:2
参考答案:C
本题解析:略
本题难度:一般
2、计算题 现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):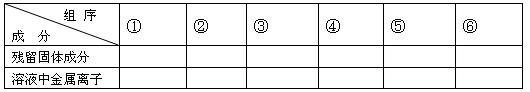
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。
参考答案:(1) 本题解析:略 本题难度:一般 3、填空题 (7分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。 参考答案:(7分,每空1分,装置图1分,第(3)小问3分) (1)2F 本题解析:(1)氯化铁能溶解单质铜,反应的方程式是2Fe3++Cu===2Fe2++Cu2+。 本题难度:一般 4、填空题 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: 参考答案:(1)Cu2S+4Fe3+=2Cu2++4Fe2++S 本题解析:(1)反应物为Cu2S和FeCl3,由流程信息可知产物有Cu2+、S,FeCl3作氧化剂,还原产物为Fe2+。Cu2S总化合价升高4,而Fe3+降低1,所以Cu2S前配1,Fe3+前配4。(2)从苯的物理性质和溶解速率着手分析。(3)NOx→HNO3,氮元素化合价由+2x→+5,化合价变化(5-2x),O2化合价降低4,守恒配平。滤液M是铁置换CuCl2中铜后的FeCl2溶液,氯化可生成循环使用的FeCl3溶液。(4)实验的目的是除铁,①加硝酸氧化Fe2+→Fe3+,②加CuO调节pH沉淀Fe3+。由于C 本题难度:困难 5、填空题 三氯化铁是合成草酸铁的重要原料。 参考答案: 本题解析: 本题难度:一般
??????组序
成?分
①
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:?????????????????????????????。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。?
正极反应式:??????????????????????,负极反应式:???????????????????????。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
???????????????????????????????????????????????????????????????????????? 氢氧化物开始沉淀时的pH 氢氧化物沉淀完全时的pH Fe3+ 1.9 3.2 Fe2+ 7.0 9.0 Cu2+ 4.7 6.7 提供的药品:Cl2 浓硫酸 NaOH溶液 CuO Cu
(2)由于原电池中负极失去电子,正极得到电子,因此根据反应式可知,负极是铜,正极可以是石墨等,而电解质溶液应该是氯化铁,装置图为(见答案)。其中电极反应式是正极:2Fe3++2e-===2Fe2+、负极:Cu-2e-===Cu2+。
(3)根据表中数据可知,沉淀亚铁离子的pH大于沉淀铜离子的pH,所以应该将溶液中的亚铁离子氧化生成铁离子,然后在调节pH将铁离子沉淀出来。即正确的做法是①通入足量氯气将Fe2+氧
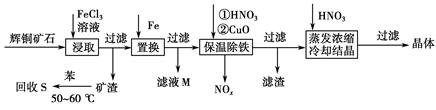
(1)写出浸取过程中Cu2S溶解的离子方程式___________________________。
(2)回收S过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是____________________、____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为______________________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是____________________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是______________________________。
⑴利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示: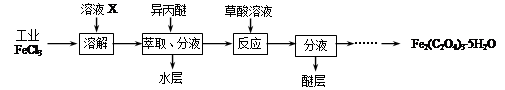
①为抑制FeCl3水解,溶液X为?????。
②上述流程中FeCl3能被异丙醚萃取,其原因是?????;检验萃取、分液后所得水层中是否含有Fe3+的方法是?????。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是?????。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于如图所示仪器?????(填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是?????。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
⑵某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3·5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;?????;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3·6H2O;?????,得到无水FeCl3。
⑴①(浓)盐酸
②FeCl3在异丙醚中的溶解度
试题分析:(1)①酸化FeCl3用盐酸酸化,不引入杂质;②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好;③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失;④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;根据高锰酸钾的量计算草酸的含量,a。没有润洗导致高锰酸钾浓度低消耗体积多,偏高;b。读数高锰酸钾体积多,偏高;c。读数体积偏小,结果偏低,正确;(2)该过程中生成亚铁离子需加双氧水氧