时间:2017-02-07 14:54:14
1、选择题 质量为ag的铜丝,在空气中灼烧变黑,趁热放入下列物质中,铜丝变为红色,而且质量仍为ag的是??????????????????????????
A.盐酸
B.2-丙醇
C.一氧化碳
D.硝酸
参考答案:BC
本题解析:
试题分析:铜在空气中加热,生成氧化铜,氧化铜能和酸反应,如果是硝酸,铜也被溶解,所以铜的质量减少。2-丙醇和CO能把氧化铜还原生成铜,因此质量不变,答案选BC。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,难易适中。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练。该题的关键是明确铜参与有关化学反应的原理,然后灵活运用即可。
本题难度:简单
2、填空题 (10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示: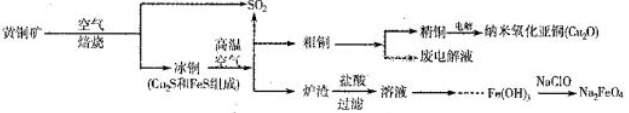
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 当吸收液呈中性时,溶液中离子浓度由大到小的顺序为是________________。 参考答案:(1)12.5mol(2分) 本题解析: 3、实验题 某校化学 91ExAm.org研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质。过程如下: 参考答案:实验探究 本题解析:略 本题难度:一般 4、实验题 (10分) 参考答案:铁和稀硫酸 氢氧化钠溶液 本题解析:要产生还原性的气体,应该用铁和稀硝酸反应生成氢气。即A中的试剂是铁和稀硫酸。利用生成的氢气排尽装置中的空气,从而可以防止氢氧化亚铁被氧化。最后利用氢气产生的越强将硫酸亚铁压入氢氧化钠中进行反应,所以B中的试剂是氢氧化钠溶液。具体的操作是①打开弹簧夹C;A中气体由导管进入B,B中有气泡;目的是为了排尽装置和溶液中的氧气,形成还原性气氛。 本题难度:一般 5、选择题 已知:2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,不可能出现的结果是 参考答案:B 本题解析: 本题难度:一般 |