时间:2017-02-02 06:45:52
1、选择题 NA表示阿伏加德罗常数,下列说法正确的是(????)
A.标准状况下11.2L的水中含有0.5NA个水分子
B.含1 mol HCl的盐酸中离子总数为NA个
C.1gH2气体中含NA个原子
D.1 mol大米中含有NA个大米粒子
参考答案:C
本题解析:考查物质的量的有关计算。标准状况下,水不是气体,不能适用于气体摩尔体积,选项A不正确;氯化氢溶于水全部电离出离子,所以含1 mol HCl的盐酸中离子总数为2NA个,选项B不正确;1g氢气水0.5mol,含有NA个氢原子,选项C正确;物质的量不能用于宏观物质,选项D不正确,答案选C。
本题难度:一般
2、选择题 2 L N2和CH4的混合气体与4 L O2点燃充分反应后,用干燥剂除去水分,剩余气体的体积为5 L。原来混合气体中N2和CH4的物质的量之比(各气体体积都在相同的温度、压强下测定)为(????????? D?????)
A.1:3
B.1:1
C.2:1
D.3:1
参考答案:D本题解析:CH4??+? 2O2------? CO2+2H2O??????△V
1??????? 2??????? 1??????????????? 2
V(CH4)???????????????????????????? 1L
V(CH4)=0.5L
本题难度:简单
3、计算题 (8分)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液。计算:
(1)该混合溶液中NaCl的质量分数。(3分)
(2)该混合溶液中NaCl的物质的量浓度。(3分)
(3)在1000 g水中需加入________摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。(保留1位小数)(2分)
参考答案:(1)20%、 (2)4mol/L、 (
本题解析:
试题分析:①将20.0g14%的NaCl溶液跟30.0g24%的NaCl溶液混合,混合后溶液的质量为20g+30g=50g,
设混合后NaCl的质量分数为ω,则:50g×ω=20g×14%+30g×24%,解得ω=20%
答:混合后NaCl溶液的质量分数为20%。
②混合后溶液中NaCl的物质的量浓度为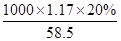 mol/L=4mol/L,
mol/L=4mol/L,
答:混合后氯化钠溶液的物质的量浓度为4mol/L.
③令需要氯化钠的物质的量为n mol,NaCl的质量为n mol×58.5g/mol="58.5n" g,则: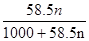 =20%,解得n=4.3,
=20%,解得n=4.3,
答:在1000g水中需要加入4.3 mol NaCl。
考点:考查物质的量的相关计算。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA
B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
参考答案:D
本题解析:
试题分析:A、16.9 g过氧化钡(BaO2)的物质的量=16.9g÷169g/mol=0.1mol,由于过氧化钡晶体中阴阳离子的个数之比是1:1,所以16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA,A正确;B、乙烯与环丁烷的最简式相同,都是CH2,所以常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子的物质的量=28g÷14g/mol=2mol,因此碳原子个数为2NA,B正确;C、1 L 0.1 mol·L-1碳酸钠溶液中溶质的物质的量=1L×0.1mol/
本题难度:一般
5、选择题 用100 mL 0.2 mol ∕ L BaCl2溶液恰好可使相同体积的Na2SO4、Al2(SO4)3、KAl(SO4)2的溶液中的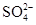 ?完全转化为BaSO4沉淀,需要三种盐溶液的溶质的物质的量浓度之比为(??)
?完全转化为BaSO4沉淀,需要三种盐溶液的溶质的物质的量浓度之比为(??)
A.6:2:3
B.3:2:2
C.3:2:1
D.1:2:3
参考答案:A
本题解析:
试题分析:100 mL 0.2 mol ∕ L BaCl2溶液恰好可使相同体积的Na2SO4、Al2(SO4)3、KAl(SO4)2的溶液中的SO42-全部转化为BaSO4说明三种溶液中的n(SO42-)是相同的。又因为这三种溶液的体积相同,所以Na2SO4、Al2(SO4)3、KAl(SO4)2三种溶液的浓度之比为:1: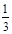 本题难度:一般
本题难度:一般