时间:2017-02-02 06:45:52
1、选择题 用98%的浓硫酸(密度为1.84 g·cm-3)配制1 mol·L-1的稀硫酸180 mL,现给出下列仪器(配制过程中可能用到):①50 mL量筒;②10 mL量筒;③50 mL烧杯;④托盘天平;⑤200 mL容量瓶;⑥胶头滴管;⑦玻璃棒。配置过程一定需要使用的仪器是( )
A.②③⑤⑥⑦
B.③④⑤⑥⑦
C.①②③⑤⑦⑥
D.①③⑤⑥⑦
参考答案:D
本题解析:由于没有180ml的容量瓶,所以应该配制200ml稀硫酸,则硫酸的物质的量是0.2mol,所以需要浓硫酸的体积是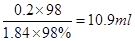 ,因此需要5ml量筒,而不需要托盘天平。所以正确的答案选D。
,因此需要5ml量筒,而不需要托盘天平。所以正确的答案选D。
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是
A.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的O2一定为0.3 NA
B.常温常压下,46 g NO2与N2O4的混合气体中含有的分子总数为NA
C.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA
D.一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子
参考答案:A
本题解析:
试题分析:A、乙醇的化学式可写成C2H4·H2O,与乙烯的混合物0.1mol完全燃烧相当于0.1mol C2H4完全燃烧消耗氧气0.3 NA,正确;B、NO2与N2O4的混合气体的最简式是NO2,所以46gNO2与N2O4的混合气体中N原子的物质的量是1mol,O原子的物质的量是2mol,但分子总数无法判断,错误;C、Ba(OH)2溶液的体积未知,所以OH-的数目无法计算,错误;D、8g氧气与钠反应生成过氧化钠或生成氧化钠,转移的电子数不同,若生成氧化钠转移NA个电子,但产物不确定,错误,答案选A
本题难度:一般
3、选择题 设阿伏加德罗常数的值为NA,下列说法中正确的是
A.17g甲基(—14CH3)所含中子数为9NA
B.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
C.0.1molC5H12分子中含有的C-C键数为0.5NA
D.标准状况下,2.24L辛烷在氧气中完全燃烧生成CO2分子数为0.8 NA
参考答案:B
本题解析:该甲基中中子数是14-6=8,A不正确。乙烯和丙烯的最简式相同,都是CH2,所以B正确。C中应该是0.4NA,不正确,标准状况下,辛烷不是气体,所以正确的答案选B。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1 mol H2O中含有电子的数目为NA
C.标准状况下,11.2 L四氯化碳中含有分子的数目为0.5NA
D.0.5 mol ·L-1 CaCl2溶液中的Cl—的数目为NA
参考答案:CD
本题解析:
试题分析:四氯化碳为态体,标况下11.2L不是0.5mol,C错误;D中没有说明溶液的体积,错误;答案选CD。
考点:阿伏加德罗常数与微观粒子的数目
本题难度:一般
5、选择题 把500mL含有氯化钡和氯化钾的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀,则该混合溶液中钾禽子浓度为(??? )
A.10(b-2a)mol/L
B.10 (b-a)mol/L
C.10(2a-a)mol/L
D.0.1(b-2a)mol/L
参考答案:A
本题解析:
试题分析:SO42-??+?? Ba2+?=? BaSO4↓;Cl-??+?? Ag+?=? AgCl↓
a mol?????? a mol????????????? bmol????? bmol
则表明每一份中含有的钾离子的物质的量为:n(K+)=(b-2a)mol
则该混合溶液中钾离子的物质的量为:5 n(K+) =5(b-2a)mol
则该混合溶液中钾离子浓度为:本题难度:一般