时间:2017-02-02 06:45:52
1、填空题 (4分)实验室配制250 mL 1.0 mol·L-1 H2SO4溶液,回答下列问题:
(1)需要18 mol·L-1 H2SO4溶液的体积是________mL。
(2)应选用下列______规格的量筒量取浓硫酸。
A.10 mL
B.25 mL
C.50 mL
D.100 mL
(3)某同学用容量瓶配制溶液,加水时不慎超过了刻度线,他(她)把水倒出一些,重新加水至刻度线。这样做会使配制溶液的浓度________(填“偏高”、“偏低”或“无影响”)。
(4)某同学在向容量瓶中转移液体时,未用蒸馏水洗涤烧杯。这样做会使配制溶液的浓度________(填“偏高”、“偏低”或“无影响”)。
参考答案:13.9; B;偏低;偏低
本题解析:
试题分析:(1)溶液稀释前后溶液中溶质的物质的量保持不变,设需要18mol?L-1 H2SO4溶液(密度为1.84g
本题难度:一般
2、选择题 设NA代表阿伏加德罗常数的值,下列有关叙述正确的是(??)
A.1 mol CH4(g)和2 mol O2(g)的能量总和小于1 mol CO2(g)和2 mol H2O(g)的能量总和
B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
C.1 mol Fe在氧气中充分燃烧失去3NA个电子
D.在标准状况下,NA个CHCl3分子所占的体积约为22.4 L
参考答案:B
本题解析:A项,由于甲烷的燃烧是放热反应,所以反应物总能量应大于生成物总能量,错误;B项,因为发生2NO2 N2O4,造成气体分子数小于2NA;C项,Fe在O2中燃烧生成Fe3O4,1 mol Fe失去
N2O4,造成气体分子数小于2NA;C项,Fe在O2中燃烧生成Fe3O4,1 mol Fe失去本题难度:一般
3、选择题 NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.1 mol甲基的电子数目为7NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
参考答案:D
本题解析:
试题分析:标准状况下,戊烷不是气态,不能适合于气体摩尔体积,A不正确;乙烯分子中含有6对共用电子对,B不正确,28g乙烯所含共用电子对数目为6NA;1 mol甲基的电子数目为9NA,C不正确;乙烯、丙烯、丁烯的最简式都是CH2,所以乙烯、丙烯、丁烯的混合气体共14g,其原子的物质的量是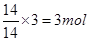 ,个数为3NA,D正确,答案选D。
,个数为3NA,D正确,答案选D。
考点:考查阿伏加德罗常数的有关计算和判断
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
4、计算题 常温下,在35.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.20g /cm3,求:
(1)该溶液中阴阳离子的总物质的量
(2)该溶液中CuSO4的物质的量浓度
(3)取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
参考答案:(1)0.100 mol(2)1.25 mol /L(3)2
本题解析:
试题分析:(1)硫酸铜的物质的量为:12.5/250mol=0.050mol,电离产生的Cu2+和SO42-均为0.050mol,阴、阳离子的总物质的量为0.050mol+0.050mol=0.100mol。
(2)溶液的体积为:(12.5+35.5)/1200L=0.04L,CuSO4的物质的量浓度为:0.05mol/0.04L=1.25mol/L.
(3)取出溶液中硫酸铜的物质的量浓度仍为1.25mol/L,溶液稀释前后,溶质物质的量不变, 1.25mol/L×0.02L=1mol
本题难度:一般
5、实验题 某同学按下列步骤配制500mL 0.2mol·L-1 Na2SO4溶液,填空并回答有关问题。
| 实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为 克 |
| ②称量Na2SO4固体 | |
| ③将Na2SO4加入100mL烧杯中,并加入适量水溶解 | |
| ④将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1—2厘米处应如何操作: |
| ⑥摇匀 | (1)上述实验步骤中缺一会严重影响溶液浓度的重要步骤,请简述此操作步骤: 若不完善此步骤,所得溶液浓度 (填偏高、偏低、无影响) (2)配制Na2SO4溶液时,下列操作情况会使结果偏高的是 。 A.移液前,容量瓶中有少量蒸馏水 B.溶解搅拌时有液体飞溅 C.定容时俯视容量瓶瓶颈刻度线 D.定容后,倒置容量瓶摇匀后,液面低于刻度线,再加水定容 参考答案:14.2, 转移过程中用玻棒进行引流, 本题解析: 本题难度:一般 |