时间:2017-02-02 06:29:52
1、选择题 将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如右
图所示。则下列说法不正确的是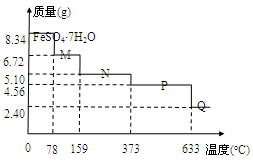
A.在100℃时,M的化学式为FeSO4·4H2O
B.FeSO4·7H2O晶体中有4种不同结合力的水分子
C.FeSO4·H2O存在的最高温度为373℃
D.380℃的P加热至650℃时的化学方程式为:2FeSO4 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
参考答案:B
本题解析:
试题分析:8.34 g FeSO4·7H2O 的物质的量是0.03mol。A、在100℃时,M的质量为6.72g,减少了1.62g水,剩余0.12mol的水,所以FeSO4与H2O的物质的量比是1:4,正确;B、晶体中水分子的结合力是相同的,错误;C、FeSO4·H2O中水的物质的量为0.03mol,其质量是5.1g,所以由图可知FeSO4·H2O存在的最高温度为373℃,正确;D、P点对应的物质的质量是4.56g,为FeSO4的质量,Q点的质量是2.4g为Fe2O3的质量,所以从P到Q发生反应的
本题难度:一般
2、选择题 下列说法正确的是
A.1mol任何物质都含有阿伏加德罗常数个原子
B.CO2的摩尔质量为44g
C.标准状况下,1mol任何物质其体积都约为22.4L
D.同温同压下,相同体积的任何气体所含分子数相同
参考答案:D
本题解析:
试题分析:1mol任何物质都含有阿伏加德罗常数个微粒,但不一定是原子,A不正确;摩尔质量的单位是g/mol,B不正确;标准状况下,1mol任何气体其体积都约为22.4L,C不正确;根据阿伏加德罗定律可知,D正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,侧重对基础知识的巩固与检验。该题的关键是特别要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:简单
3、选择题 在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.0.1mol
B.0.5mol
C.0.15mol
D.0.25mol
参考答案:B
本题解析:因溶液中的离子有K+、Cl-、Mg2+、SO42,设SO42-物质的量为n,根据电荷守恒:1.5mol×1+0.5mol×2=1.5mol×1+n×2,解得n=0.5mol.
故选:B.
点评:本题考查溶液中的电荷守恒知识,可以根据所学知识进行回答,比较简单.
本题难度:一般
4、填空题 l mol CO2的质量是一个CO2分子质量的 倍,l mol CO2的质量与CO2的相对分子质量相比,两者 相同,但前者以 为单位。5molCO32-是 g,它和 mol Mg2+含有相同的质量,它和 gSO42-含有相同的离子数。(12分)
参考答案:6.02×1023,数值,克,300g,,12.5mol,4
本题解析:略
本题难度:一般
5、计算题 (6分)实验室中需要11.2L(标准状况)二氧化碳,现用含碳酸钙90.0
参考答案:
本题解析:
本题难度:一般