1、选择题 由H2、O2、CO2组成的混合气体的密度是同温同压下CH4密度的2倍,三种气体组分的物质的量之比不可能是:
A? 2 :3 :5????? B? 2 :5 :5???? C? 2 :1 :5????? D? 2 :2 :7
参考答案:D
本题解析:混合气体的平均式量为16×2=32,而混合气体中氧气的式量恰好也为32,只需要H2和CO2的平均式量为32即可,由十字交叉法可知二者的物质的量之比为2:5,所以答案为D
本题难度:一般
2、选择题 已知某溶液中c(Na+)=0.2 mol/L,c(Mg2+)=0.25 mol/L,c(Cl-)=0.4 mol/L,如果溶液中还有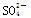 ,那么c(SO42-)应为
,那么c(SO42-)应为
A.0.1 mol/L
B.0.3 mol/L
C.0.15 mol/L
D.0.5 mol/L
参考答案:C
本题解析:
试题分析:溶液中的离子遵循电荷守恒,即溶液中的阳离子带电的电荷量与阴离子所带电电荷量相等.设SO42-物质的量浓度为c,则根据电荷守恒:0.2mol/L×1+0.25mol/L×2=0.4mol×1+2c,解得c=0.15mol/L,选C。
考点:考查电荷守恒。
本题难度:一般
3、选择题 相对分子质量为M的气态化合物V?L(标准状况),溶于m?g水中,得到质量分数为w%的溶液,物质的量浓度为c?mol/L,密度为ρ?g?cm-3,则下列说法正确的是( )
A.相对分子质量M=
22.4m×w%
(1-w%)V
B.物质的量浓度c=ρV
MV+22.4m
C.溶液的质量分数w%=MV
22.4m
D.溶液密度ρ=cM
1000×w
参考答案:A、VL气体的物质的量为的物质的量为
本题解析:
本题难度:简单
4、计算题 二氧化硫和氮氧化物(NOx)是大气的主要污染物,治理环境污染是当前环保工作的重要研究内容之一。
完成下列计算:
(1)石灰石-石膏湿法烟气脱硫工艺技术的原理是:烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4·2H2O)。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则理论上可得到_________吨石膏。
(2)用CH4催化还原NOx,主要产物为N2与CO2。现有1 L NOx(含NO2、NO),用CH4将其还原成N2,消耗同温同压下的CH4 0.4 L,则混合气体中NO2、NO的物质量之比为____。
(3)乙二酸(H2C2O4)的制备有如下反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
上述反应产生的NOx用氧气和水吸收后生成硝酸循环利用,若尾气NOx中n(NO2)
参考答案:
本题解析:
本题难度:困难
5、选择题 将钠、镁、铝各0.1 mol分别放入 足量盐酸中,同温同压下产生气体的体积比是
A.3∶1∶1
B.6∶3∶2
C.1∶2∶3
D.1∶1∶1
参考答案:C
本题解析:
试题分析:钠镁铝的物质的量相同,但失电子数不同,分别为0.1mol、0.2mol、0.3mol,根据得失电子守恒定律可得2H+~H2得到的电子数也分别为0.1mol、0.2mol、0.3mol,所以同温同压下产生气体的体积比也即物质的量比为1:2:3,答案选C。
本题难度:一般
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|
|
|
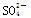 ,那么c(SO42-)应为
,那么c(SO42-)应为