时间:2017-01-24 19:19:55
1、简答题 髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料.实验室用硫铁矿烧渣(Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如图所示.请回答有关问题: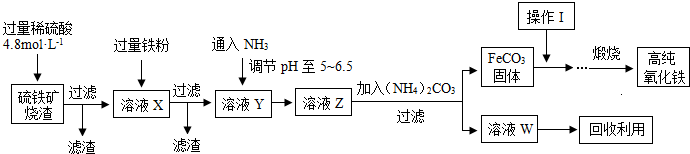
(1)过滤操作中的玻璃仪器为______.
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为______.
(3)溶液X发生反应的离子方程式为______.
(4)简述如何检验溶液Z中的阴离子______.
(5)操作I的名称是______.列举W的一种用途______.
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示)______.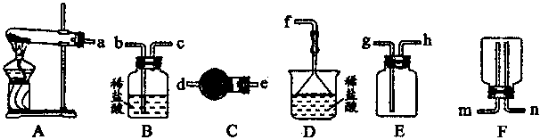
(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论______.
2、选择题 下列实验对应的结论不正确的是(???? )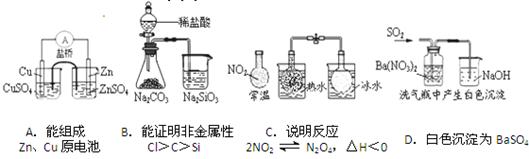 ???????????
???????????
3、选择题 下列对实验过程的评价正确的是( )
A.某固体中加入稀盐酸,产生了无色无味的气体,证明该固体一定是CaCO3
B.某溶液中加入氢氧化钠溶液并加热,产生了能使湿润的红色石蕊试纸变蓝的气体,该溶液中一定含有NH4+
C.某溶液中滴入氯化钡溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含有SO42-
D.验证NaOH溶液中是否混有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明有Cl-
4、选择题 验证乙酸乙酯密度,溶解性和水解三项性质的合理实验是(???)
A.将其滴入水中,随即滴加碱液并迅速加热至沸腾
B.将其滴入沸腾的碱液中观察
C.将其滴入水中观察片刻,再滴加含有酚酞的碱液并缓缓加热
D.将其滴入沸腾的水中观察
5、实验题 (16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答: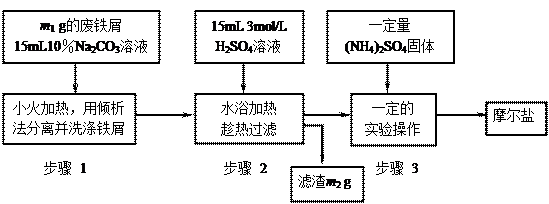
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:????????????????????? ▲???????????????????????。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有???? ▲????:
A.沉淀的颗粒较大???? B.沉淀容易沉降???? C.沉淀呈胶状??? D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示):????????▲???????。步骤2中溶液趁热过滤的原因是??????????? ▲???????????。
中铁屑过量的目的是(用离子方程式表示):????????▲???????。步骤2中溶液趁热过滤的原因是??????????? ▲???????????。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到???? ▲???????时,停止加热。需经过的实验操作包括:?? ▲?????、 ▲ 、减压过滤(或抽滤)等得到较为??????? ▲??????????的晶体。
加热到???? ▲???????时,停止加热。需经过的实验操作包括:?? ▲?????、 ▲ 、减压过滤(或抽滤)等得到较为??????? ▲??????????的晶体。
(5)抽滤装置的仪器有:?? ▲?????、?? ▲?????、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
???Fe2++???MnO4-+(??????? )="?" ??Mn2++?????Fe3++????H2O
②本实验的指示剂??? ▲??????????。
A.酚酞??? B.甲基橙?? C.石蕊?? D.不需要
③KMnO4溶液置于??? ▲?????? (酸式、碱式)滴定管中
④终点颜色的变化:????????? ▲???????????????????????????。
⑤产品中Fe2+的质量分数为??? ▲??????。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:???? ▲???????。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:???? ▲???????。(用a,b,c回答)