时间:2017-01-24 19:19:55
1、实验题 测量一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g·cm-3)、水。按图2-1-2装置进行实验,回答下列问题(设合金样品全部反应,产生的气体不超过100mL)。
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗倒扣在样品上面。
(2)合金样品用铜网包裹的目的是:
参考答案:
(1)
②往烧杯中注入水,直至水面没过漏斗颈末
本题解析:
【错解分析】常见错解分析:?第(1)问:①使烧杯注满浓盐酸。②烧杯注满水;烧杯注入1/2(或400mL)水;少量水,使水面浸没量筒上;使水面至漏斗口下方等。③用量筒盛满浓盐酸后,倒置在漏斗口上(先向烧杯注入2/3体积水)。④从漏斗口向漏斗里注入浓盐酸,再把量筒盛满水,拇指堵住量筒口,倒置,松开拇指,使量筒倒置在漏斗上。⑤将量筒用铁架台固定在漏斗上方,向烧杯里注满水,使水充满量筒。⑥另画一整套装置图作答,与本题给出的图示装置无关。第(2)问:①铜网包裹下,减慢速率。②因反应剧烈,合金会飞溅,冲出漏斗。③防止合金被氧化。④铜丝是催化剂。⑤形成原电池,使反应加速等。
出现①误区,是由于不明确实验目的,对实验的关键步骤不清楚,造成失误。如果真的使烧杯注满浓盐酸,合金已经与盐酸反应了,气体并未收集,无法实现实验目的。出现②误区,是由于不理解实验中加水量的关键位置是“直至水面没过漏斗颈末端”,而是主观地确定了一些加水的标准,导致失误。出现③误区,是由于这是一步危险操作,且无法实现本实验目的,导致失误。出现④误区,是由于犯了与①误区实质相同的错误,无法完成定量实验,造成失误。出现⑤误区,是由于设计不合理,对“气体是有体积的”不清楚,水无法进入倒置的充满空气的量筒中,造成失误。出现⑥误区,是由于答非所问,把题目完全理解错了,导致失误。
【正解】粗读题目,对试题的整体有所了解,标出关键字词。细读题目,第(1)问要弄清以下几个问题:
1.实验目的:通过测量一定质量的铝锌合金与强酸溶液反应产生H2的体积,求得合金中铝和锌的质量分数。
2.实验用品:中学化学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g·cm-3)水。
3.实验装置:按图示装置进行实验。
4.实验步骤:给出第①步,要求补充实验步骤,直到反应开始进行。
5.核心问题:完成量取气体体积的定量实验。
审清题目要求后,在“图示”的启发下,迅速联想自左而右的制气装置、集气装置,将其迁移至此,变成自下而上的制气装置、集气装置(兼量气装置),按照准备好气体发生装置和收集装置的顺序,然后加入试剂,使反应发生的思路,补充②、③、④实验步骤,问题便迎刃而解。
本题难度:一般
2、简答题 美国科学家理查德一海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖.有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收.一种由废催化剂制取氯化钯的工艺流程如下:
(1)废钯催化剂经烘干后,再在700℃的高温下焙烧,焙烧过程中需通入足量空气的原因是______;甲酸还原氧化钯的化学方程式为______.
(2)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为______.
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯精渣的适宜条件(温度、时间和王水用量)为______、______、______.
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是______(写化学式).
(5)700℃焙烧1的目的是:______;550℃焙烧2的目的是:______.
参考答案:废钯催化剂经烘干后,再在700℃的高温下焙烧,Fe、Pd、有
本题解析:
本题难度:一般
3、实验题 在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。 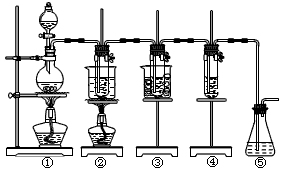
图中:
①为氯气发生装置;
②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;
③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:___________________。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。


参考答案:(1)分液漏斗;B
(2)碱溶液(或反应物)的浓度不
本题解析:
本题难度:一般
4、实验题 为了探究铁与氯气在一定条件下反应后的固体中铁元素的价态,化学兴趣小组的甲、乙、丙三同学分别进行了如下实验。
(1)甲取少许反应后的固体,加入适量稀硝酸,在所得溶液中滴加KSCN溶液出现血红色,则此时溶液显血红色的离子方程式为_______________________________________。该同学由此得出铁与氯气的反应产物中含有+3价铁的结论。请指出该结论是否合理并说明理由_________________________________________________________。
(2)乙取少许反应后的固体,加入盐酸,溶解、过滤,向滤液中滴加KSCN溶液,溶液呈无色。乙由此得出铁与氯气的反应产物中含有+2价铁的结论。请指出该结论是否合理并说明理由
____________________________________________________________。
(3)丙取11.2g铁粉与氯气反应,将反应后所得固体研碎分成两等份,其中一份用磁铁吸引,吸出的固体质量为1.4g;另一份用水完全溶解后加入足量的硝酸银溶液,所得白色沉淀经洗涤干燥后称重为32.29g。根据以上数据确定反应产物中铁元素的价态是____________(写出计算和推理过程)。
参考答案:(1)Fe3+ + 3SCN- = Fe(SCN)3???不
本题解析:略
本题难度:简单
5、实验题 (10分)在食品加工领域,应用二氧化硫的最主要原因是避免氧化和防腐。在我国葡萄酒中二氧化硫的最大使用量为0.2500g/kg,二氧化硫残留量不得超过0.05000g/kg。葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定S02+2KOH?="=" K2S03+H20;然后加入硫酸又使二氧化硫游离,K2S03+H2S04? ="=" K2S04+H2O+S02↑;加入过量的I2氧化S02;过量的I2可用硫代硫酸钠进行滴定,I2+2Na2S203="=" Na2S406+ 2NaI。
以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12g/ml)中二氧化硫的含量是否超标的实验方案。
实验步骤:
①用移液管量取50.00ml样品于250ml锥形瓶中,加入25.00 ml1mol/L氢氧化钾溶液,加塞,摇匀;
②静置15min;
③打开塞子,加入25.00ml1:3硫酸溶液使溶液呈酸性,再加入25.00ml0.01000mol/L碘溶液,迅速的加塞,摇匀;
④用??????滴定管移取步骤 ③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论。
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是:??????????????;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是?????????????;
(3)步骤④的A溶液最合适的是????????????;滴定终点的判断方法是???????????????????????????????????????????????????????????????????????;
(4)步骤④应该选用???????????(填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S203溶液的体积数据记录如下:
| 序号 | 滴定前/mL | 滴定后/mL |
| ① | 1.35 | 19.40 |
| ② | 1.05 | 19.00 |
| ③ | 1.58 | 20. 91 91 根据数据计算该样品中总二氧化硫的浓度为??????mol/L,故该干白葡萄酒是??????(填“合格”“不合格”)产品。 参考答案:(10分) 本题解析:略 本题难度:一般 |