时间:2017-01-19 10:21:33
1、选择题 室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
A.若PH>7,则一定是C1V1=C2V2
B.在任何情况下都是C(Na+)+C(H+)=C(CH3COO-) +C(OH-)
C.当PH=7时,若V1=V2,一定是C2>C1
D.若V1=V2,C1=C2,则C(CH3COO-) +C(CH3COOH)=C(Na+)
2、填空题 (10分)运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=???????????;用离子方程式表示FeCl3溶液用于净水的原因??????????????????????????????????????????????????。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。
在NaHSO4溶液中c(H+)??????????c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH?????????7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为????????????????????????????????。(已知Ksp(BaSO4)=1.1×10-10)
(4)写出下列反应的化学方程式:
苯的硝化反应 ???????????????????????。 乙醇的催化氧化反应????????????????。
3、填空题 (7分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为???????(填序号)。
A.9
B.13
C.11~13之间
D.9~11之间
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
????????????????????????c(CH3COO-)(填“>”、“=”或“<”)。
(3)常温下,已知某NH4Cl溶液中的c(NH4+)=c(Cl一),则该溶液的pH???7(填“>”、“=”或“<”)。
(4)如果将HCl和CH3COONa溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为????????????????????????????
4、选择题 己知:HCN(aq)与NaOH(aq)反应的△H="-12.1" kJ/mol;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ/mol。则HCN在水溶液中电离的△H等于( )
A.-67.7 kJ/mol
B.-43.5 kJ/mol
C.+43.5 kJ/mol
D.+67.7 kJ/mol
5、判断题 在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
| 加入盐酸体积V/Ml | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/ ℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 (1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。 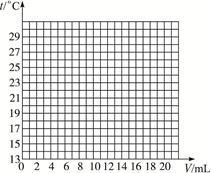 (2)根据曲线讨论溶液温度变化的原因。 ①加入盐酸的量在2—10 mL之间时:_____________________________________________; ②加入盐酸的量在10—20 mL之间时:____________________________________________。 (3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么? 答:__________________________________________________________________________。 |