时间:2017-01-17 23:39:16
1、实验题 (10分)向溴水中加入足量乙醛溶液,可以观察到溴水褪色。对产生该现象的原因有如
下三种猜想:①溴水与乙醛发生了取代反应;②溴水与乙醛发生了加成反应③溴水将乙醛氧化成乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性
方案二:测定反应前溴水中Br2的物质的量和反应后Br-的物质的量
(1)方案一是否可行??????,理由???????????????????????????????????????
(2)假设方案二中测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=
????????mol,说明溴水与乙醛发生了取代反应;若测得反应后n(Br-)=???????mol,说明溴水与乙醛发生了加成反应;若测得反应后n(Br-)=???????mol,则说明溴水将乙醛氧化成乙酸。
参考答案:(1)不可行;乙醛与溴水发生取代反应或氧化反应后溶液均呈酸性
本题解析:题目中,猜想有三种:溴水分别与乙醛发生取代、加成及氧化。方案一中,无论取代(生成HBr)或氧化乙醛(生成CH3COOH),均使反应后溶液显酸性,故不可行。方案二中,由于发生三种反应后溶液中Br-的量存在差异,故方案二可行;且由于乙醛是足量的,溴水中的溴全部参与反应:取代反应中生成n(Br-)="a" mol,加成反应中n(Br-)="0" mol,氧反应中n(Br-)="2a" mol。
本题难度:一般
2、实验题 某铝合金中含有单质铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验流程,请回答有关问题:
(1)步骤1所得固体甲的成分为?????????????????。
(2)步骤2中加足量盐酸,而不采用通入足量二氧化碳的原因为??????????????????????????????????????????????????????????????????????。
(3)步骤3中生成固体丙的离子方程式为???????????????????????????????????;溶液C中所含有的阳离子符号为????????????????。
(4)步骤4所发生反应的化学方程式为?????????????????????????????????????。
(5)现用托盘天平称取10.0g铝合金进行上述流程图所示操作,所得固体丁质量为15.3g,则该铝合金中铝的质量分数为??????????????????;并判断以下操作对铝质量分数测定的影响(填“偏大”、“偏小”或“无影响”)。
a.步骤1中烧碱量不足,则????????????????;
b.步骤4中灼烧不充分,则????????????????。
参考答案:(16分)
(1)镁、铜(2分)
(2)通入二氧
本题解析:
试题分析:(1)镁、铜不与烧碱溶液反应,故固体甲的成分为镁、铜。
(2)氢氧化铝沉淀可以和盐酸反应,而不能和二氧化碳反应,故不采用通入足量二氧化碳的原因是通入二氧化碳得到硅酸与氢氧化铝的固体混合物,无法将硅、铝元素分离开来。
(3)氢氧化铝沉淀不再与氨水反应,故步骤3中生成固体丙的离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+。溶液C中所含有的阳离子符号为Na+、NH4+。
(4)丙是氢氧化铝,故反应方程式为2Al(OH)3 ?Al2O3 + 3H2O。
?Al2O3 + 3H2O。
(5)Al→1/2Al2O3
27g??? 51g
m????? 15.3g
51g×m=27g×15.3g
解得m=8.1g
故10.0g铝合金中铝的质量分数为81.0%。
a.步骤1中烧碱量不足,Al反应不完,故偏小。
b.步骤1中灼烧不充分,丁的质量将偏大,故铝质量分数测定要偏大。
点评:本题考查学生对实验与操作原理、物质的分离提纯、物质含量的测定、化学计算等,难度中等,清楚实验原理是解题的关键,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析问题解决问题的能力。
本题难度:一般
3、实验题
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.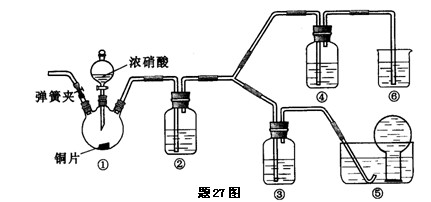
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应.2NO2+2NaOH=NaNO3+NaNO2+H2O (1)装置①中发生反应的离子方程式是???????????????????????????????????????.
(2)装置②的目的是????????????????????????????????,发生反应的化学方程式是???????????????????????????????????????????????????????????????????????.
(3)实验应避免有害气体排放到空气中,装置③、④、⑤、⑥中盛放的药品依次是
?????????????????????????????????????????????????????????????????????.
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后打开弹簧夹,通入
???????????目的是????????????????????????????????????????????????????.
(5)该小组得出的结论所依据的实验现象是???????????????????????????????????.
参考答案:
(1)Cu + 4H+ + 2NO3-(浓) = C
本题解析:略
本题难度:简单
4、填空题 开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是______(填字母).
a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源.下列制氢的方法中,最节能的是______(填字母).
a.电解水制氢:2H2O
|