时间:2017-01-15 17:52:22
1、选择题 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10。下列说法不正确的是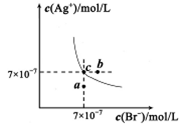
A.在t℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
参考答案:B
本题解析:根据图中c点的c(Ag+)和c(Br-)可得,该温度下AgBr的Ksp为4.9×10-13,A正确;在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,沉淀溶解平衡逆向移动,c(Ag+)减小,平衡点仍在曲线上,B错误;在a点时Qc<Ksp,故为AgBr的不饱和溶液,C正确;选项D中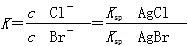 ,代入数据得K≈816,
,代入数据得K≈816,
本题难度:一般
2、选择题 已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是(? )
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.所加的烧碱溶液pH=13
D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
参考答案:C
本题解析:加入一定量的烧碱溶液测得pH=13,则所加烧碱溶液的pH大于13,故C项错误,A、B、D项正确。
本题难度:一般
3、选择题 (3分)下列说法不正确的是__________。
A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
B.对于Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
参考答案:(3分)? A C
本题解析:A错,如氢氧化钠溶解会放出热量;B正确,Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq)  ?Al3++3OH-,前者为溶
?Al3++3OH-,前者为溶
本题难度:一般
4、填空题 (14分)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 试回答以下几个问题: (1)若25< t1< t2,则a??????1×10-14(填“<”、“>”或“=”),由此判断的理由是: ??????????????????????????????????????????????????????????? (2)在25 ℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:????????? (3)若某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-)=_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3 mol·L-1,则c(OH-)=_______________。 参考答案:(1)﹥??水的电离为吸热反应,升高温度,平衡向着正反应方向 本题解析:考查水的电离 本题难度:简单 5、选择题 一定温度下,下列叙述正确的是 参考答案:C 本题解析: 本题难度:一般 |