时间:2025-06-26 04:05:48
1、选择题 设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
B.物质的量浓度为0.1mol·L-1的MgCl2溶液中,含有Cl-个数为0.2NA
C.标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA
D.常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA
2、选择题 下列溶液中Cl-浓度最大的是
[? ]
A.0.4 mol·L-1 AlCl3
B.0.8 mol·L-1 NaCl
C.0.5 mol·L-1 MgCl2
D.1.5 mol·L-1 KClO3
3、实验题 某化学实验室需要0.2mol/L NaOH溶液500 mL和0.5 mol/L硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是?(填序号),配制上述溶液还需用到的玻璃仪器是??(填仪器名称)。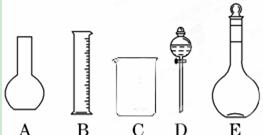
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的___________(填写序号)。
①温度?②浓度?③容量?④压强?⑤酸式或碱式?⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)?。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀?
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为:??mL(计算结果保留一位小数)。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________________。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏小(填写字母)?。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
4、选择题 NA表示阿伏加德罗常数,下列判断正确的是? ( )
A.在18 g18O2中含有2NA个氧原子
B.1 mol H2与1 mol Cl2反应生成NA个HCl分子
C.1 mol Ca变成Ca2+时失去的电子数为2NA
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
5、选择题 常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
| ? | 一氧化氮 | 硝酸 | 转移的电子 |
| A. | 1mol | ? | 2NA |
| B. | 11.2L | 1mol | ? |
| C. | ? | 63g | 2mol |
| D. | ? | 1mol | ? NA |