时间:2025-06-26 03:57:34
1、填空题 以水氯镁石(主要成分为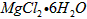 )为原料生产碱式碳酸镁的主要流程如下
)为原料生产碱式碳酸镁的主要流程如下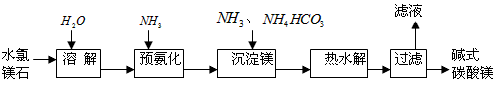
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的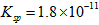 ,若溶液中
,若溶液中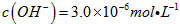 ,则溶液中
,则溶液中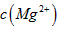 =_______________。
=_______________。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为__________________。
(3)高温煅烧碱式碳酸镁得到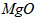 。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下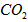 0.896L,通过计算确定碱式碳酸镁的化学式。__________________________
0.896L,通过计算确定碱式碳酸镁的化学式。__________________________
(4)若热水解不完全,所得碱式碳酸镁中将混有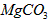 ,则产品中镁的质量分数_____________(填 “升高”、“降低”或“不变”)。
,则产品中镁的质量分数_____________(填 “升高”、“降低”或“不变”)。
参考答案:(1)2.0 mol·L
(2)NH4Cl (3)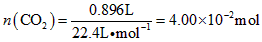
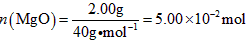
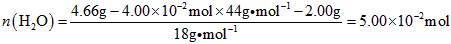
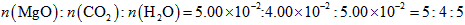
碱式碳酸镁的化学式为: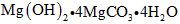 (4)升高
(4)升高
本题解析:
本题难度:困难
2、填空题 硫酸铁铵 [a(NH4)2SO4·bFe2(SO4)3·cH2O] 常作为高铁的标准,可用于测定卤素的指示剂。某工厂实验室用一种硫酸亚铁样品(含少量硝酸钙)和硫酸铵为原料,设计如下工艺过程,制取硫酸铁铵: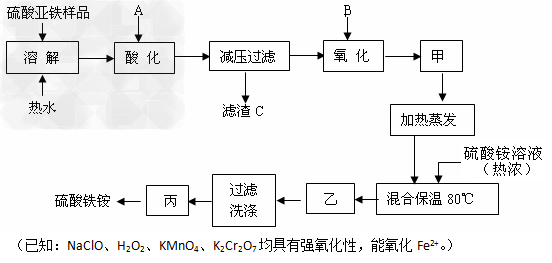
请完成下列填空:
(1)写出A、B适宜的化学式:A? 、B? 。
(2)减压过滤得到的滤渣C,其主要成分是? (填化学式)。操作甲的目的是:? 。
(3)操作乙、丙的名称分别是:乙? ,丙? 。
(4)检验产品硫酸铁铵中的阳离子,相关的离子方程式有? 。
(5)为了用重量法确定产品硫酸铁铵[a(NH4)2SO4·bFe2(SO4)3·cH2O]中a、b、c的值(供选用的试剂:浓硫酸、碱石灰、氢氧化钠、氯化钡),除了测得取用样品的质量外,至少还需要测定? 。灼烧固体所需要的仪器是______________(选出合适的选项)
?A.坩埚 B.滤纸 C.酒精喷灯 D.玻璃棒
参考答案:(1) H2SO4 ;H2O2?
(2)CaSO4;检验Fe2+是否已全部被氧化。
(3)冷却结晶;常温晾干?
(4) NH4++OH- NH3↑+H2O 、 Fe3++3SCN-
NH3↑+H2O 、 Fe3++3SCN- Fe(SCN)3?
Fe(SCN)3?
(5) 2; 蒸发皿、玻棒、酒精灯
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是( )
A.天然气是一种清洁燃料,主要由石油分馏制得
B.海水淡化的方法主要有蒸馏法、电渗析法、离子交换膜法等
C.煤的干馏和石油的分馏都是化学变化
D.石油裂化的目的是使直链烃转化为芳香烃
参考答案:B
本题解析:
本题难度:简单
4、填空题 中国青铜文化源远流长,铜及其化合物在现代生产生活中仍然有极其重要的作用。
(1)考古发掘中经常出土青铜器,青铜器出土后,防止青铜器继续锈蚀的关键是_________。
(2)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂。在实验室里可模拟工业过程制取氧化亚铜,总反应的方程式是:2Cu+H2O Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。
Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。 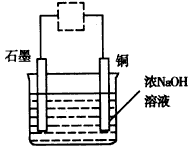
A.图中虚线框内需连接直流电源,且正极与石墨相连
B.氧化铜高温分解也可能得到氧化亚铜
C.在上述装置中,阳极的电极反应式是2Cu-2e-+2OH-=Cu2O+H2O
(3)硫酸铜是一种应用极其广泛的化工原料,现用废铜(主要杂质为Fe)作原料来制备胆矾,有人设计了如下流程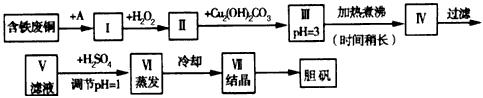
pH的控制可参考下列数据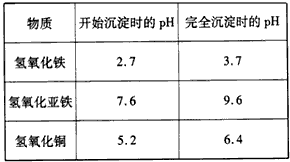
请根据上述流程回答下列问题:
①A物质最好选用______(填字母)。
a.稀H2SO4和O2 b.浓H2SO4 c.浓FeCl3溶液 d.酸性KMnO4溶液
②I中加H2O2的目的是_________________(用离子方程式表示)。Ⅱ中加Cu2(OH)2CO3的目的是_____________。
③Ⅲ中加热煮沸时发生反应的离子方程式为________________。
④V中加H2SO4调节pH=1是为了____________。
参考答案:(1)隔绝空气和水
(2)A
(3)①a;②Fe2++ H2O2+2H+=2Fe3++2H2O;除去过量的硫酸;③Fe3++3H2O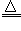 Fe(OH)3↓+3H+;④抑制
Fe(OH)3↓+3H+;④抑制
Cu2+的水解
本题解析:
本题难度:一般
5、填空题 我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如图所示(图中某些转化步骤及生成物未列出):请填写下列空白: 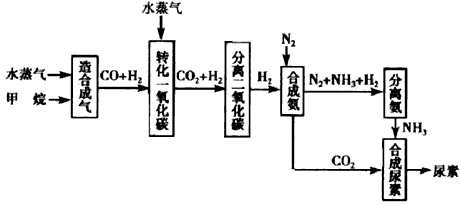
(1)已知0.5mol甲烷和 0.5 mol水蒸气在t℃,p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了
a kJ热量。该反应的热化学方程式是____________________
(2)上述流程中,工业上分离H2、CO2合理的方法是__________
A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B.混合气加压冷却,使CO2液化
C.混合气用氨水洗涤
D.混合气先通入到石灰浆,然后高温煅烧固体
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行_________,目的是_____________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出来氨的方法:____________________
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。
参考答案:(1)CH4(g)+H2O(g)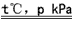 CO(g)+3H2(g) △H=+2a kJ/mol
CO(g)+3H2(g) △H=+2a kJ/mol
(2)BC
(3)净化;防止空气中某些杂质使催化剂中毒;液化氨(或分离液态氨)
(4)由分离氨的框用箭头指向合成氨框;分离二氧化碳框指向合成尿素框
本题解析:
本题难度:一般