时间:2025-06-26 03:57:34
1、选择题 下列叙述不正确的是( ? )
A.工业上可用碳在高温下还原二氧化硅制取硅
B.工业上可用氯气和石灰乳为原料制造漂白粉
C.镁条不能在二氧化碳气体中燃烧
D.将盛有氢氧化铁胶体的烧杯置于暗处,用一束光照射,从垂直于光线的方向可以观察到一条光亮的通路
2、选择题 最近,我国从新疆开发天然气,通过管道输送到上海等东部城市,下列有关天然气的说法中不正确的是( )
A.天然气和沼气的主要成分都是甲烷
B.用液化石油气主要成分为丙烷的炉具与用天然气的炉具不能通用,需要调整和更换
C.天然气是比燃油更清洁的燃料,产物污染少
D.用天然气替代汽油作为汽车燃料,是因为使用起来更方便
3、填空题 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO4、Ba(FeO2)2等]。某主要生产BaCl2、
BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下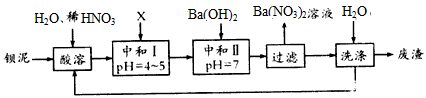
(1)酸溶后溶液中pH =1,Ba(FeO2)2与HNO3的反应化学方程式为________________。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是____________、_________________
(3)该厂结合本厂实际,选用的X为____________ (填化学式);中和I使溶液中________(填离子符号)的浓度减少(中和I引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是____________________
4、简答题 绝大部分金属的冶炼都是通过再高温下发生的氧化还原反应来完成的,实验室利用铝热反应来模拟这种冶炼方法,实验装置如图.
(1)铝热反应的化学方程式为______.
(2)描述“铝热反应”的现象______.
(3)有的同学推测,铝热反应所得到的生成物是铁铝合金.设计一个简单的实验方案,证明所得的物质中含有金属铝.该实验所用的试剂是______,当观察到______现象时,说明生成物中含有金属铝.
5、填空题 二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在)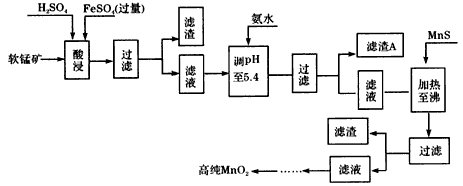
某软锰矿的主要成分为MnO2,还含Si(16. 27%)、Fe(5. 86%)、Al(3. 24%)、Zn (2.68%)和Cu(0. 86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题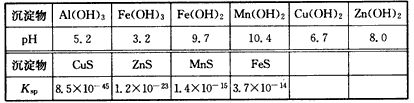
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为_________________。
(2)滤渣A的主要成分为__________。
(3)加入MnS的目的是除去__________杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为_______________。
(5)从废旧碱性锌锰电池中可回收利用的物质有_______________(写两种)。