时间:2025-06-26 03:49:07
1、填空题 (10分)
高锰酸钾是锰的重要化合物和常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。请回答下列问题:
(1)通常高锰酸钾保存在棕色试剂瓶中,下列试剂不需要用棕色试剂瓶保存的是?(填字母代号)。
a. 浓硝酸? b. 氯水? c. 烧碱
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质不同的是?(填字母代号)。
a. 84消毒液(主要成分是NaClO)? b. 75%酒精
c. 臭氧? d. 双氧水
(3)写出MnO2催化H2O2溶液制氧气的化学方程式?。
(4)在用软锰矿制备高锰酸钾的生产中需要纯净的CO2气体。
①若实验室要制备纯净的CO2,从下列给出的试剂中最好选择?(填字母代号)。
a. 石灰石? b. 浓盐酸? c. 稀硫酸? d. 纯碱
②与上述所选试剂对应的气体发生装置是?(填字母代号)。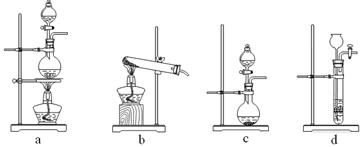
(5)①通常状况下,酸性高锰酸钾溶液不能与下列物质中的?反应(填字母代号)。
a. 乙醇? b. Na2SO3溶液? c. 环己烯? d. 苯? e. FeSO4溶液
②将用稀硫酸酸化的高锰酸钾溶液滴入盛有足量草酸溶液的试管中,振荡后,观察到的现象是?。已知1mol草酸参加反应时转移的电子数是2×6.02×1023,锰元素在生成物中的化合价为+2。请写出此反应的化学方程式?。
2、填空题 钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时,却可与常见的非金属单质反应,钛是航空、军事、电力等方面的必需原料。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石、炭粉混合,在高温条件下,通入Cl2制得TiCl4和一种可燃气体,该反应的化学方程式为__________________________________________________________,该反应的还原剂是__________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式____________________________________________________。
(2)简述从上述所得产物中获得金属钛的步骤。
__________________________________________________________________。
3、选择题 FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为
A.1:6
B.2:15
C.2:11
D.1:7
4、选择题 下图标出了各种材料强度与密度的比值以及广泛使用的年代。
(1)从图中可以看出的信息有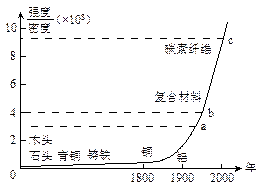
A.科学技术的发展越来越快,新材料频频出现? B.新材料发展的总体趋势是强度越来越大
C.1800年以前出现的材料强度都比铝小? D.铝的密度比钢的密度大
(2)有甲、乙两种材料,它们的强度相同,甲的密度是乙的2倍。且甲材料在图中的b点对应,则乙材料在图的位置是
A.a点? B.a、b之间? C.c点? D.b、c之间
5、选择题 已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
A.NO2
B.NO
C.N2O
D.NH4NO3