ʱ��:2025-06-26 03:49:07
1��ѡ���� ������CuS��Cu2S�Ļ����Ͷ��������HNO3�У��ռ�������VL����״��������Ӧ�����Һ�У�����Cu2+��SO42-����������NaOH��������ɫ���������ˣ�ϴ�ӣ����գ��õ�CuO12.0g������������ΪNO��NO2�Ļ����������Ϊ1�s1����V����Ϊ��?��
A��9.0L
B��13.5L
C��15.7L
D��16.8L
�ο��𰸣�A
�����������ͭ�غ��֪CuS��Cu2S�к���n(Cu)��12.0g/80g��mol-1��0.15mol�����õ����غ㣬���ݡ����˼��跨����֪���������ȫ��ΪCuSʱ�ɵã�0.15mol��8��n(NO)��3+n(NO2) ��1����n(NO)��n(NO2)����֮��n(NO)��n(NO2)��0.3mol����Ӧ���û�������ڱ���µ����V����0.3mol+0.3mol����22.4mol��L-1��13.44L���������ȫ��ΪCu2Sʱ�ɵã�
10��0.15mol/2��n(NO)��3+n(NO2) ��1
��n(NO)��n(NO2)����֮��n(NO)��n(NO2)��0.1875mol����Ӧ���û�������ڱ���µ����V����0.1875mol+0.1875mol����22.4mol��L-1��8.4L,�����ռ������������8.4L��V��13.44L����ѡA��
�����Ѷȣ�һ��
2������� ��6�֣���ƽ������������ӷ���ʽ��
?HCl + ?KClO3=?Cl2 + ?KCl+ ?[? ]
�ο��𰸣�6��1��3��1��3 ��H2O ÿ��1��
�������������������ԭ��Ӧ����ʽ����ƽ����������ԭ��Ӧ�е��ӵĵ�ʧ�������غ�ģ��ݴ˽�����ƽ���ڷ�Ӧ��HCl����Ԫ�صĻ��ϼ��ɣ�1�����ߵ�0�ۣ��仯1����λ�����������Ԫ�صĻ��ϼ��ɣ�5�۽��͵�0�ۣ��仯5����λ�����ڻ�ԭ���������������ʵ���֮����5�U1������Ϊ�������Ȼ����е���ԭ���������Ȼ����еģ�����ԭ���غ��֪����һ����������ˮ�����Է�ӦʽΪ6HCl + KClO3=3Cl2 + KCl+3H2O��
�����Ѷȣ�һ��
3��ѡ���� п�ͺ�ϡ�������ַ�Ӧ��������п����������ʵ�����Ϊ1:2.5ʱ������������п��ˮ֮�������һ�����ʣ������ʿ�����
��NO2 ��.N2O ��.NO ��.NH4NO3
A���٢�
B���٢�
C���ڢ�
D���ۢ�
�ο��𰸣�C
�����������μӷ�Ӧ��п��4mol����������10mol��4molпʧȥ8mol���ӣ�ͬʱ����4mol����п�����ݵ��ӵĵ�ʧ�غ��֪���������2mol����ȫ������ԭ����1mol����õ�4mol���ӣ���˵�ԭ�ӵĻ��ϼ۽��͵���1�ۣ����ֻ��1mol����ԭ����Ԫ�صĻ��ϼ۽��͵���3�ۣ����Դ�ѡC��
�����Ѷȣ�һ��
4������� 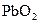 �Ǻ�ǿ������������������Һ�����ɽ�
�Ǻ�ǿ������������������Һ�����ɽ�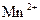 ������
������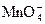 ��ȡ1֧�Թܣ���������
��ȡ1֧�Թܣ���������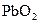 �����2mL6 mol
�����2mL6 mol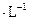
 ��Ȼ�����2mL1 mol
��Ȼ�����2mL1 mol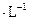
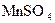 ��Һ���Իش�
��Һ���Իش�
(1)?�������Һ����ɫ�仯��_____________________________?
(2)?��Ӧ�Ļ�ѧ����ʽ��__________?_�������������_____________?___
(3)?�ܷ����������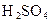 _______?_(��ܡ����ܡ�)���û�ѧ����ʽ�ش�
_______?_(��ܡ����ܡ�)���û�ѧ����ʽ�ش�
_____________?__
�ο��𰸣�(1) ��Ϊ�Ϻ�ɫ
(2) 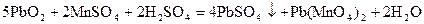 ?�ữ
?�ữ
(3) ����
�����������
�����Ѷȣ���
5��ѡ���� ��bLFeBr2��Һ��ͨ��amolCl2ʱ��ʹ��Һ��50%��Br-����ΪBr2����ԭFeBr2�����ʵ���Ũ��Ϊ(? )
A��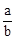 mol��L-1
mol��L-1
B��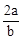 mol��L-1
mol��L-1
C��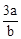 mol��L-1
mol��L-1
D��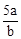 mol��L-1
mol��L-1
�ο��𰸣�A
�����������FeBr2��Һ��ͨ��Cl2�����ڻ�ԭ��Fe2+>Br -������Fe2+ �ȱ�������������bLFeBr2��Һ��Ũ��Ϊc������:?
2Fe2+ + Cl2 = 2F3++2Cl- ?2Br - + Cl2 = Br2+2Cl-
2 ?:? 1? 2? : 1
bc ?0��5bc? bc? 0��5bc
����n(Cl2)=bc=amol������c=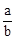 ?mol��L-1 ����ѡB��
?mol��L-1 ����ѡB��
�����Ѷȣ�һ��