时间:2025-06-26 03:49:07
1、选择题 将0.3mol KMnO4在一定温度下加热后生成x molO2;将剩余固体与过量浓盐酸混合加热又生成y mol Cl2,此时锰元素全部以Mn2+形式存在。若x+y=a,则a的值可能为
A.0.85
B.0.75
C.0.65
D.0.60
参考答案:CD
本题解析:若初始的KMnO4完全分解,可得到0.15molO2,继续氧化浓盐酸,得0.45molCl2(由化学方程式计算或由电子得失守恒可得)
若初始KMnO4未分解,全部用来氧化盐酸,最终可得0.75molCl2
因为有氧气,所以气体的物质的量应为大于等于0.65mol,小于0.75mol
本题难度:一般
2、填空题 向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):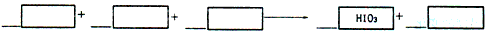
(2)把KI换成KBr,则CCl4层变为_________色;继续滴加氯水,CCl4层的颜色没有变化。则Cl2、
HIO3、HBrO3的氧化性由强到弱的顺序是____________________。
参考答案:(1)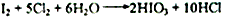
(2)橙红;
本题解析:
本题难度:一般
3、填空题 (9分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数) 。
。
(1) 元素在周期表中位置是?,其原子结构示意图?;
元素在周期表中位置是?,其原子结构示意图?;
(2) 与最活跃的非金属元素A形成化合物D,D的电子式为?;
与最活跃的非金属元素A形成化合物D,D的电子式为?;
(3)配平用钙线氧脱鳞的化学方程式:
?P +?FeO + ?CaO  ??Ca3(PO4)2 + ?Fe;
??Ca3(PO4)2 + ?Fe;
(4)将钙线试样溶于稀盐酸,加入过量 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测 的方法是?(用离子方程式表达);
的方法是?(用离子方程式表达);
(5)取1.6g钙线试样,与水充分反映,生成224ml.H2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3?g。
参考答案:(1)第四周期第ⅡA族, ?(2)
?(2)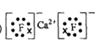
(3)2P + 5FeO + 3CaO Ca3(PO4)2+5Fe
Ca3(PO4)2+5Fe
(4)Fe3+ + 3SCN-="=" Fe(SCN)3
(5)1.1?(各2分)
本题解析:最活泼的非金属是F,即A的化学式为CaCl2,含有离子键,属于离子化合物。由方程式可知P的化合价升高5个单位,铁的化合价降低2个单位,根据得失电子守恒可以配平。白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,说明 是铁离子,可用KSCN检验。1.6g钙线试样含有氧化钙
是铁离子,可用KSCN检验。1.6g钙线试样含有氧化钙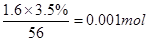 。生成224ml.H2(标准状况),因此金属钙的物质的量是
。生成224ml.H2(标准状况),因此金属钙的物质的量是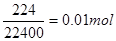 ,即最后溶液含有0.011mol钙离子,所以最终的碳酸钙沉淀是0.011mo×100g/mol=1.1g。
,即最后溶液含有0.011mol钙离子,所以最终的碳酸钙沉淀是0.011mo×100g/mol=1.1g。
本题难度:简单
4、填空题 铁能在稀硝酸中溶解: →Fe(NO3)3+NO↑+2H2O
→Fe(NO3)3+NO↑+2H2O
24.在上述方程式上标出电子转移的方向和数目。
25.该反应中被还原的元素是 ,还原剂是 。
26.若有0.1 mol铁参加反应,被还原的HNO3为 mol。
参考答案:24.略,(2分,方向和数目各1分)。
25.+5价的N(1分),铁(1分)。
26.0.1(2分)
本题解析:24.在方程式中Fe→Fe3+,失去3e-,故 。
。
25.反应中化合价降低的元素是被还原,为+5价N,失去电子的物质是还原剂,是Fe。
26.反应中被还原的HNO3生成NO,故有0.1 mol铁参加反应,被还原的HNO3为0.1mol。
考点:氧化还原反应的概念及相关计算。
本题难度:一般
5、填空题 (1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)  ?CO(g)+2H2(g);△H= -36kJ/mol……… ①
?CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列说法正确的是?____
A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol
B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲
烷的物质的量之比为6∶1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为? _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为? _______
(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平:? __________________
参考答案:(1)①D?②1.35?(2)Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
本题解析:(1)①A.(② -①)×2可得2H2O(g)  O2(g)+2H2(g) △H= +504kJ/mol.错误.B. 对于反应①在何时刻都有υ(CH4)正=υ(CO)正,故不能表明该反应达平衡状态。错误。C.反应①②的正反应都是气体体积增大的反应。所以,其它条件不变时,增大体系压强,反应①②的平衡都是想逆反应方向移动。故二者中的甲烷的转化率均减小。错误。D.假设发生①的甲烷的物质的量为X,发生②的甲烷的物质的量为Y。为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,则36X=216Y。解得X:Y="6:1." 消耗甲烷的物质的量之比为6∶1。正确。选项为:D。②化学平衡常数K={C(CO)·C3(H2)}/{C(CH4)·C(H2O)}={0.5×1.53}{0.5×2.5}=1.35.(2)第三步反应的方程式为:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
O2(g)+2H2(g) △H= +504kJ/mol.错误.B. 对于反应①在何时刻都有υ(CH4)正=υ(CO)正,故不能表明该反应达平衡状态。错误。C.反应①②的正反应都是气体体积增大的反应。所以,其它条件不变时,增大体系压强,反应①②的平衡都是想逆反应方向移动。故二者中的甲烷的转化率均减小。错误。D.假设发生①的甲烷的物质的量为X,发生②的甲烷的物质的量为Y。为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,则36X=216Y。解得X:Y="6:1." 消耗甲烷的物质的量之比为6∶1。正确。选项为:D。②化学平衡常数K={C(CO)·C3(H2)}/{C(CH4)·C(H2O)}={0.5×1.53}{0.5×2.5}=1.35.(2)第三步反应的方程式为:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
本题难度:一般