时间:2025-06-26 03:25:33
1、选择题 下列各组元素的原子随着原子序数的递增,有关递变不正确的是(?)
A.最高正价:P<S<Cl<Ar
B.原子半径:C>N>O>F
C.金属性:Na<K<Rb<Cs
D.最外层电子数:Na<Mg<Al<Si
参考答案:A
本题解析:A不正确,Ar是稀有气体,没有正价,其余选项都是正确的,答案选A。
点评:该题是中等难度的试题,主要是考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。有助于培养学生的逻辑思维能力和应试能力,提高学生的答题效率。
本题难度:一般
2、填空题 (10分)下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
参考答案:除2个化学方程式各2分外,其余每空1分
(1)E(2)①C+4HNO3==CO2+4NO2+2H2O ②2Na2O2+2CO2==2Na2CO3+O2
?(3) PCl3或CCl4的电子式(略)原子
(4)羧基?(5)氮? ce
本题解析:略
本题难度:一般
3、选择题 某阳离子Mn+的核外共有x个电子,核内有a个中子,则M的质量数为?
A.a+x-n
B.a+x+n
C.a-x-n
D.a-x+n
参考答案:B
本题解析:阳离子Mn+的核外共有x个电子,则该微粒的质子数=x+2。又因为质子数+中子数=质量数,则质量数=x+2+a,答案选B。
点评:该题是高考中的常见题型,试题以核燃料为载体,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:一般
4、选择题 下列叙述与对应图式正确的是
A.由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强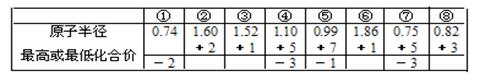
B.图甲表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2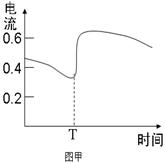
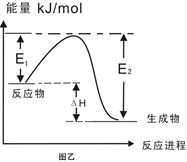
C.图乙表示某一放热反应,若使用催化剂E1、E2、ΔH都会发生改变
D.表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H= -571.6kJ/mol
参考答案:B
本题解析:A、根据同主族自上而下,原子半径逐渐增大可知,③是Li,⑥是Na,所以⑥最高价氧化物对应的水化物碱性最强,A不正确;B、双氧水具有强氧化性,能加快反应速率,所以电流强度增大,B正确;C、催化剂只能改变活化能,但不能改变反应热,C不正确;D、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以表示H2燃烧热的热化学方程式为H2(g)+ O2(g)=H2O(l)?△H=-285.8kJ/mol,D不正确,答案选B。
O2(g)=H2O(l)?△H=-285.8kJ/mol,D不正确,答案选B。
本题难度:一般
5、选择题 下列物质中属于纯净物的是
A.明矾
B.水玻璃
C.盐酸
D.黄铜
参考答案:A
本题解析:试题分析:由一种物质构成的是纯净物,A正确,其余选项都是混合物,答案选A。
考点:考查纯净物、混合物的判断
点评:该题是基础性试题的考查,难度不大,学生记住常见物质的组成,即可得出正确的结论。
本题难度:困难