时间:2025-06-26 03:25:33
1、填空题 (共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的核外电子排布为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式:?;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为?。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式?。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为?。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为?L。
参考答案:(共12分).(1)1s22s22p4(2分)?(2)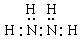 (2分)
(2分)
(3)3Cu + 2NO3— + 8H+ ="==" 3Cu2+ + 2NO↑ + 4H2O?(2分)
(4)NH4++HSO3-+2OH-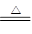 NH3+H2O+SO32-?(2分)? (5)HN3(2分);2.24L(2分)
NH3+H2O+SO32-?(2分)? (5)HN3(2分);2.24L(2分)
本题解析:X是原子半径最小的元素,则X是H。如果设Y的质子数是a,则根据元素的结构及位置可知,Z、W的质子数分别是a+1和a+9,因此有1+a+a+1+a+9=32,解得a=7,所以Y是N,Z是O,W是S。
(1)根据构造原理可知,氧原子的核外电子排布为1s22s22p4。
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,所以甲的化学式是N2H4,其电子式是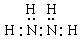
(3)该强酸是硝酸,反应的方程式是3Cu + 2NO3— + 8H+ ="==" 3Cu2+ + 2NO↑ + 4H2O。
(4)1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况),说明含有1个NH4+,所以乙是亚磷酸氢铵,和过量的氢氧化钠反应的方程式是NH4++HSO3-+2OH-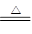 NH3+H2O+SO32-。
NH3+H2O+SO32-。
(5)氮原子的个数是43×0.977÷14=3,所以氢原子数是1个,即分子式是HN3;2.15g该化合物的物质的量是0.05mol。反应的方程式是2HN3=H2+3N2,所以生成氢气和氮气的物质的量分别是0.025mol和0.075mol,共计是0.1mol,标准状况下的体积是2.24L。
本题难度:一般
2、选择题 以下分类正确的是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,电离时生成金属离子(或铵根离子)和酸根离子的化合物是盐,单质是由同种元素组成的纯净物,氧化物是由两种元素组成并且一种元素是氧元素的化合物.
解答:A、HD是单质,水是氧化物,硫酸属于酸,烧碱氢氧化钠属于碱,胆矾是硫酸铜的晶体属于盐,故A正确;
B、黄铜是由铜和锌所组成的合金,属于混合物,不是单质,故B错误;
C、碘酒是碘的酒精溶液,属于混合物,不是单质,故C错误;
D、纯碱是碳酸钠,属于盐类,故D错误.
故选A.
点评:本题考查学生物质的分类知识和对概念的掌握和理解程度,是一道基础知识题目,较简单.
本题难度:困难
3、填空题 (13分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为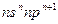 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是??(填元素符号或化 学式,下同);第一电离能从大到小的顺序是?
学式,下同);第一电离能从大到小的顺序是?
(2)C原子的电子排布图 _____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式_?_,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为?杂化,空间构型为__?。
(4) C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为?,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为?。
参考答案:(共13分每空1分,除离子反应) (1)Na>C>N>O;? N>O>C>Na
(1)Na>C>N>O;? N>O>C>Na
(2) 略?,H-O-O-H?,极性键和非极性键?,极性
(3)略? SP2?平面三角形
(4)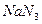 ;
; 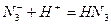 (2分)
(2分)
本题解析:略
本题难度:一般
4、填空题 (12分,每空2分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是?。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
参考答案:(1)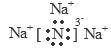 ;离子?离子;(2) 两?Na3N+4HCl==3NaCl+NH4Cl; (3)<
;离子?离子;(2) 两?Na3N+4HCl==3NaCl+NH4Cl; (3)<
本题解析:(1)Na3N是离子化合物;在Na与N原子之间通过离子键结合。Na3N的电子式是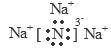 。(2)Na3N与盐酸反应的方程式Na3N+4HCl=3NaCl+ NH4Cl.因此生成2种盐。(3)Na+、N3-的核外都是2、8的电子层结构。对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。因此在Na3N中两种微粒的半径:r(Na+)<r(N3-)。
。(2)Na3N与盐酸反应的方程式Na3N+4HCl=3NaCl+ NH4Cl.因此生成2种盐。(3)Na+、N3-的核外都是2、8的电子层结构。对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。因此在Na3N中两种微粒的半径:r(Na+)<r(N3-)。
本题难度:一般
5、填空题 工业上将磷酸钙、石英砂和炭粉混在电弧炉中焙烧来制取白磷:
Ca3(PO4)2+SiO2+C—CaSiO3+P4+CO↑
(1)配平以上方程式
?Ca3(PO4)2+ ?SiO2+?C=?CaSiO3+?P4+ ?CO↑
(2)已知白磷熔点为44.1℃,熔点280℃,据此判断其晶体类型属于?
(3)有一种磷的结构式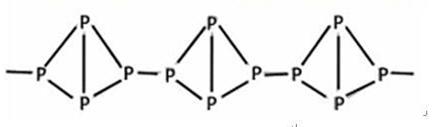 ,
,
有关它的叙述肯定不正确的是?
A.它在空气中完全燃烧的产物是P2O5
B.它不溶于水
C.它在常温下呈固态
D.它与白磷互为同分异构体
参考答案:(1)2,6,10,6,1,10,2(2分)
(2)分子晶体(2分)?(3)D (2分)
本题解析:(1)依据电子得失守恒定律,即可配平;
(2)分子晶体熔点低,常在数百度以下至很低温度,白磷的熔点44.1℃、沸点280℃可推测是分子晶体。
(3)在题干中绘制了红磷的结构。不管是白磷或红磷,当在空气中完全燃烧时,产物都是P2O5。白磷、红磷或其他磷的同素异形体都不溶于水,在常温下也都是固态的。这种磷与白磷是同素异形体,但不是同分异构体,所以D不正确。
点评:本题考查化学方程式的配平,晶体类型的判断和磷及其性质,综合性较强,题目难度中等。
本题难度:一般