时间:2025-06-26 03:25:33
1、填空题 (共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的核外电子排布为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式:?;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为?。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式?。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为?。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为?L。
2、选择题 以下分类正确的是
A.A
B.B
C.C
D.D
3、填空题 (13分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为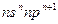 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是??(填元素符号或化 学式,下同);第一电离能从大到小的顺序是?
学式,下同);第一电离能从大到小的顺序是?
(2)C原子的电子排布图 _____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式_?_,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为?杂化,空间构型为__?。
(4) C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为?,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为?。
4、填空题 (12分,每空2分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是?。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
5、填空题 工业上将磷酸钙、石英砂和炭粉混在电弧炉中焙烧来制取白磷:
Ca3(PO4)2+SiO2+C—CaSiO3+P4+CO↑
(1)配平以上方程式
?Ca3(PO4)2+ ?SiO2+?C=?CaSiO3+?P4+ ?CO↑
(2)已知白磷熔点为44.1℃,熔点280℃,据此判断其晶体类型属于?
(3)有一种磷的结构式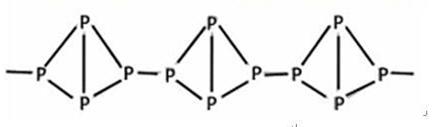 ,
,
有关它的叙述肯定不正确的是?
A.它在空气中完全燃烧的产物是P2O5
B.它不溶于水
C.它在常温下呈固态
D.它与白磷互为同分异构体