时间:2025-06-26 02:56:57
1、实验题 氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.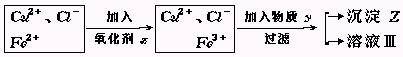
↓蒸发结晶
CuCl2·2H2O(纯)
(1)加入氧化剂X的目的是?
(2)下列氧化剂中最适合本实验的是?
A.H2O2
B.KMnO4
C.NaClO
D.K2Cr2O7
(3)物质Y和沉淀Z的化学式分别是?和?.
(已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
参考答案:(1)使溶液A中的Fe2+氧化成Fe3+;? (2)A? (3)Y:CuO或Cu(OH)2? Z:Fe(OH)3
本题解析:本题是对一个实验问题进行理论分析.
解答本题的关键是理解题中提供的一条中学未曾接触的信息的含意.由于Fe2+沉淀为Fe(OH)2的PH值与Cu2+沉淀为Cu(OH)2的PH较大,而与Fe3+沉淀为Fe(OH)3的PH相差较大,所以可以通过先将Fe2+氧化为Fe3+,再调节溶液的PH使铁以Fe(OH)3沉淀形式而被除去.为了使加入的氧化剂不带入新的杂质,显然用H2O2最好.出于同样的考虑,加入y调节溶液PH值时,应选用能与H+反应,而溶解度较小的物质如CuO为好,CuO稍多不会带入新杂质也不会使PH值升高太多而使Cu2+沉淀.
本题难度:一般
2、实验题 (16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).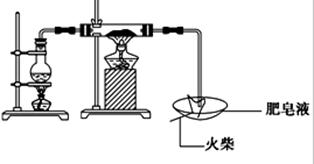
(1)如何检查该装置的气密性:?
(2)写出铁与水蒸气反应的化学方程式?
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| ? | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的?,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | ? |
| 步骤2 | 取少量步骤1中滤液于试管中,? ? | ? ? |
| 步骤3 | 取少量步骤1中滤液于试管中,? ? | ? ? |
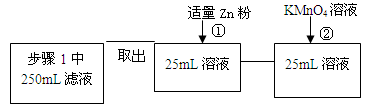
参考答案:
(1)将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱。(2分)
(2)3Fe+4H2O(g)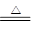 Fe3O4+4H2(2分)
Fe3O4+4H2(2分)
(3)
?
实验步骤
预期现象与结论
步骤1
3mol/L H2SO4(2分)
?
步骤2
滴加1~2滴20%KSCN(2分)
溶液变红色,则固体产物含+3价铁(1分)
步骤3
滴加1~2滴0.01mol/L KMnO4(2分)
溶液紫色褪去,则固体产物含+2价铁(1分)
?
除去反应后固体中可能未反应完的铁粉,以免影响后续实验的结果分析。
(4)将Fe3+还原为Fe2+?(2分)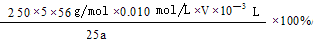 (2分)
(2分)
本题解析:
(1)检查装置的气密性有加热法和液压法,从本装置的情况看,应该选用加热法,注意操作要C处将导管伸入水槽,并微热A处圆底烧瓶,现象是导管末端出现气泡,停止加热后导管末端出现一段水柱,结论是气密性良好,用操作现象结论的思维进程去答题。
(2)书写这个方程式要注意金属和水反应的特点,如常见的Na、Mg、Al、Fe等金属与水的反应。
(3)验证固体产物中铁元素的价态 ,先要将固体溶解,但考虑到可能有铁单质剩余,会和三价铁离子反应,所以要先除去铁单质,选用的试剂是硫酸铜溶液,然然,剩余的固体则应用稀硫酸溶解(因为硝酸的氧化性会氧化二价铁),接着确定检验相应离子的试剂,三价铁离子用的是硫氰化钾溶液,而检验二价铁则从限选试剂中只能用高锰酸钾溶液,利用二价铁离子的还原性,答题时注意试剂的用量和叙述即可。
(4)弄清实验目的“固体产物中铁元素的质量分数的测定”,所以由加入锌粉后溶液的黄色恰好消失,可知是用于还原三价铁离子;由题意可知,n(Fe2+)=5n(MnO4-) m(Fe)=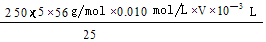 ,再求质量分数即可
,再求质量分数即可
本题难度:一般
3、选择题 过量的铁粉与稀硫酸反应后,溶液中存在较多的阳离子是
A.Fe3+
B.Fe2+
C.H+
D.Fe3+和Fe2+
参考答案:B
本题解析:由于铁粉过量,故溶液中的H+几乎被消耗完,而铁粉与水反应会产生Fe2+,故溶液中存在较多的阳离子是Fe2+,由于铁粉过量故不存在Fe3+。故答案选B
点评:本题需要学生对铁性质及Fe2+与 Fe3+互相转化的理解,但由于是过量的铁粉,所以三价不存在。
本题难度:一般
4、填空题 由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是?。
(2)用离子方程式表示过程②中稀硝酸的作用?,在该过程中要不断向溶液中补充盐酸,目的是?。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3?
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因?。
(4)过程ⅱ中产生FeCl2的化学方程式是?。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
参考答案:(1)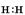 (1分)
(1分)
(2)3Fe2+ + NO3- + 4H+ ="3" Fe3+ + NO↑+ 2H2O (2分)
补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质(2分)
(3) 6SOCl2 + FeCl3?6H2O = FeCl3 + 12HCl↑+ 6SO2↑,生成的HCl会抑制FeCl3的水解,得到无水FeCl3(2分)
(4)2FeCl3 + H2?△ ?2FeCl2 + 2HCl(2分)
(5)a c (1分)
(6)4FeCl2 + H2O + O2?△ ?2FeCl3 + Fe2O3+ 2HCl(2分)
本题解析:铁和盐酸反应生成FeCl2和氢气,加入硝酸氧化为FeCl3,还有盐酸抑制Fe3+的水解,补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质,最后结晶获得晶体。
本题难度:困难
5、填空题 在FeSO4溶液中滴加入少量KSCN溶液,溶液颜色?,
再滴入几滴氯水,溶液颜色?,因为有?生成。
实验室配制的FeCl2溶液由于各种原因很容易变质,为了防止其水解,我们经常在里面加入____;为了防止其被氧化,经常加入_____,相应的化学反应方程式为_________________。_______
参考答案:
本题解析:略
本题难度:简单