时间:2025-06-26 02:56:57
1、选择题 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,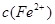 的变化如图所示。下列离子方程式错误的是(? )
的变化如图所示。下列离子方程式错误的是(? )
A.0~1 : Fe+ NO3—+4H+=Fe3++ NO↑+2H2O
B.1~2 : Fe+2Fe3+ =3Fe2+
C.2~3 : Fe+Cu2+=Fe2++Cu
D.0~3 : 3Fe+2Fe3++2Cu2+ =5Fe2++2Cu
参考答案:D
本题解析:氧化性强弱关系为: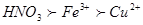 ,所以A正确,0~1段为铁与硝酸反应生成硝酸铁;B正确,1~2 段内反应为:Fe+2Fe3+ =3Fe2+;C正确,2~3 段内反应为: Fe+Cu2+=Fe2++Cu;D错,因开始为硝酸与铁反应有硝酸的参与;
,所以A正确,0~1段为铁与硝酸反应生成硝酸铁;B正确,1~2 段内反应为:Fe+2Fe3+ =3Fe2+;C正确,2~3 段内反应为: Fe+Cu2+=Fe2++Cu;D错,因开始为硝酸与铁反应有硝酸的参与;
本题难度:一般
2、选择题 根据下列框图分析,下列说法正确的是( )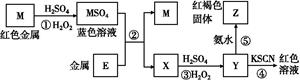
A.E3+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN-+E3+ E(SCN)3↓
E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
参考答案:D
本题解析:M是红色金属,则可以确定是金属铜,在H2O2作用下与H2SO4反应生成CuSO4,Y遇到KSCN出现红色,Y中有Fe3+,则金属E是铁,X是FeSO4,经③步反应氧化为Fe2(SO4)3,与氨水反应得到红褐色的Fe(OH)3。Fe3+的氧化性比Cu2+的氧化性强,A错;在反应①中硫酸只表现了酸性,H2O2表现了氧化性,B错;SCN-与Fe3+反应生成的产物是可溶于水的配离子,C错;反应③为:2Fe2++H2O2+2H+ 2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
本题难度:一般
3、选择题 把铁片加到1 L 1 mol/L的氯化铁溶液中,当反应后溶液中Fe3+和Fe2+物质的量浓度相等时,铁片减少的质量为
A.2.8 g
B.5.6 g
C.11.2 g
D.1.4 g
参考答案:C
本题解析:发生Fe+2Fe3+=3Fe2+,设有xmol铁反应,生成Fe2+为3xmol,剩下Fe3+为1-2xmol,有3x=1-2x,x=0.2mol,故答案为C。
本题难度:一般
4、实验题 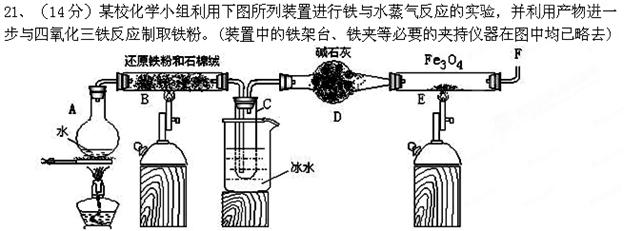
(1)烧瓶A中加入碎瓷片,其作用是?;装置C处烧杯中加冰水的作用是__?___?_。
(2)装置B中发生反应的化学方程式是__?____;装置E中发生反应的化学方程式是___?____。
(3)为了安全,在装置E中的反应发生前,在F出口处必须?;
(4)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴 加KSCN溶液。溶液颜色无明显变化,试解释原因?。
加KSCN溶液。溶液颜色无明显变化,试解释原因?。
参考答案:
本题解析:略
本题难度:一般
5、实验题 一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2:?。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为?。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。
①按如图装置连接好仪器(暂不装入药品),?。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹,?,即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 | 预期现象和结论 |
| ? | ? |
参考答案:(1)产物为Fe3O4
(2)Fe与Fe2O3反应的产物为Fe3O4(表述合理即可)
(3)①夹上弹簧夹a,松开弹簧夹b,微热玻璃管,若导管口有气泡冒出,停止加热一段时间后,导管中形成一段水柱,则装置不漏气 ③通入纯净干燥的二氧化碳气体,待玻璃管里的空气被排完了
(4)
实验步骤
预期现象和结论
步骤1:用磁铁靠近黑色粉末
黑色粉末在空气中不变色,且能被磁铁全部吸引,说明黑色粉末中没有FeO
步骤2:取少量黑色粉末,放入试管中,加入稀盐酸,振荡使粉末溶解,然后滴入几滴KSCN溶液
有气泡冒出,溶液变红色,说明铁粉过量,生成物为Fe3O4
(5)Fe+4Fe2O3 3Fe3O4
3Fe3O4
本题解析:实验要在无氧环境中进行。检验Fe3O4时,一是要利用它的磁性排除Fe2O3、FeO的干扰,二是要检验+3价铁离子的存在,排除铁的干扰。
本题难度:一般