时间:2025-06-26 02:56:57
1、实验题 氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.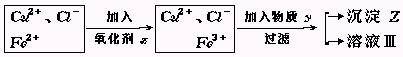
↓蒸发结晶
CuCl2·2H2O(纯)
(1)加入氧化剂X的目的是?
(2)下列氧化剂中最适合本实验的是?
A.H2O2
B.KMnO4
C.NaClO
D.K2Cr2O7
(3)物质Y和沉淀Z的化学式分别是?和?.
(已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
2、实验题 (16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).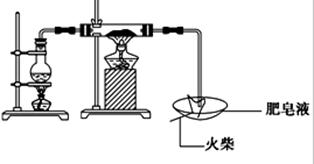
(1)如何检查该装置的气密性:?
(2)写出铁与水蒸气反应的化学方程式?
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| ? | 实验步骤 | 预期现象与结论 |
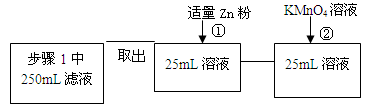
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的?,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | ? |
| 步骤2 | 取少量步骤1中滤液于试管中,? ? | ? ? |
| 步骤3 | 取少量步骤1中滤液于试管中,? ? | ? ? |
3、选择题 过量的铁粉与稀硫酸反应后,溶液中存在较多的阳离子是
A.Fe3+
B.Fe2+
C.H+
D.Fe3+和Fe2+
4、填空题 由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是?。
(2)用离子方程式表示过程②中稀硝酸的作用?,在该过程中要不断向溶液中补充盐酸,目的是?。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3?
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因?。
(4)过程ⅱ中产生FeCl2的化学方程式是?。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
5、填空题 在FeSO4溶液中滴加入少量KSCN溶液,溶液颜色?,
再滴入几滴氯水,溶液颜色?,因为有?生成。
实验室配制的FeCl2溶液由于各种原因很容易变质,为了防止其水解,我们经常在里面加入____;为了防止其被氧化,经常加入_____,相应的化学反应方程式为_________________。_______