时间:2025-06-26 02:55:18
1、选择题 无机化学命名委员会(国际组织)在1989年作出决定:把周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法正确的是
A.第3列元素种类最多,第14列的化合物种类最多
B.每1列都有非金属元素
C.从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低
D.只有第2列元素的原子最外层有2个电子
参考答案:A
本题解析:
本题难度:困难
2、选择题 下列比较中正确的是
A.原子半径:S>F
B.溶液酸性:HNO3<H2CO3
C.溶液碱性:KOH>RbOH
D.硫与氢气反应比氟与氢气反应更容易
参考答案:A
本题解析:解析:原子半径:S>O、O>F,所以S>F,A正确.C、N同周期,最高价氧化物对应水化物酸性自左向右依次增强,B错误.K、Rb同主族,最高价氧化物对应水化物碱性从上向下逐渐增强,C错误.与H2结合能力:F2>O2,O2>S,故F2>S,D错误.
思路导引:对A、D进行逻辑推理,对B、C进行递变推理.
本题难度:一般
3、选择题 下列关于元素周期表的说法错误的是( )
A.元素周期表是元素周期律的具体表现形式
B.是先有元素周期律,再有元素周期表的
C.中学课本上的元素周期表是常用的一种形式,也是唯一的一种形式
D.元素周期律是指元素的性质随着原子序数的递增而呈周期性的变化的规律
参考答案:A.周期表是按照原子序数大小排列的,每一周期具有相同的电子层数,每一族元素的价电子数目相等,性质相似,同时按照原子序数的递增呈周期性变化,故A正确;
B.元素周期表是元素周期律的具体表现形式,先有了元素周期律,然后门捷列夫才作出了元素周期表,故B正确;
C.不只有门捷列夫作出了元素周期表,还有别人的不一样的排列方式,故C错误;
D.原子核外电子呈现周期性的变化,所以元素的性质随着原子序数的递增而呈周期性的变化的规律,故D正确.
故选C.
本题解析:
本题难度:一般
4、推断题 W、X、 ?Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。 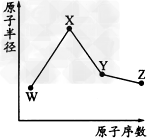
(1)X位于元素周期表中第____?周期第____ 族;W的基态原子核外有____个未成对电子。
(2)X的单质和Y的单质相比,熔点较高的是________(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是____(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是
____________________________。
(4)写出Y的气态氢化物在空气中燃烧的反应方程式__________________。
参考答案:
(1)3;IA;2?
(2)Si;HCl?
(3)SiCl4+3H2O= H2SiO3↓+4HCl?
(4)SiH4?+2O2 SiO2+2H2O
SiO2+2H2O
本题解析:
本题难度:一般
5、选择题 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是( )
A.碳酸铯的化学式为Cs2CO3
B.氢氧化铯是一种强碱
C.以电解熔融的CsCl制取铯
D.Cs2CO3加热易分解出CO2、Cs2O
参考答案:A.钠和铯都是碱金属元素,Cs的离子为+1价,碳酸铯的化学式为Cs2CO3,故A正确;
B.金属性Cs>Na,故碱性比氢氧化钠强,氢氧化铯是一种强碱,故B正确;
C.Cs的金属性很强,可以用电解熔融的CsCl制备Cs,故C正确;
D.碳酸铯与碳酸钠性质类似,加热不易分解出CO2、Cs2O,故D错误,
故选D.
本题解析:
本题难度:一般