时间:2025-06-26 02:42:14
1、填空题 (1)①在配制FeCl3溶液时,常在溶液中加入一些_________________以抑制其水解;其水解反应的离子方程式为?
②用Al2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式________________________________________________________。?
③请按顺序排列出1mol/LNH4Cl溶液中各种离子浓度大小关系_________。请详细解释该溶液呈现酸性、碱性或中性的原因_______________________?。
(2)25℃时,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得溶液的pH=10。试回答以下问题:
所得溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(3)将相同温度下相同浓度的下列溶液:
A.HCl
B.CH3COOH
C.NH4Cl
D.CH3COONa E.NaOH F.NaCl
按pH由大到小的顺序排列?(填序号)
(4)加热蒸干AlCl3溶液得到?;接下来灼烧得?;(填化学式)
用离子方程式及简短的文字说明原因?
参考答案:(1)①盐酸离子方程式为? Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
②离子方程式Al3++3HCO3=3Al(OH)3+3CO2
③离子浓度大小关系_c(Cl-)>c(NH4+).>c(H+)>COH-);NH4+与水电离出的OH-结合生成弱电解质NH3.H2O,破坏了水的电离平衡,导致c(H+)>COH-)
(2)①>(3)E>D>F>C>B>A
(4)? Al(OH)3?;? Al2O3?;(填化学式)
在AlCl3溶液中存在平衡AlCl3?+3H2O Al (OH)3+3HCl加热时, HCl不断挥发,使平衡右移,从而生成了Al (OH)3.灼烧时2Al(OH)3=Al2O3+3H2O
Al (OH)3+3HCl加热时, HCl不断挥发,使平衡右移,从而生成了Al (OH)3.灼烧时2Al(OH)3=Al2O3+3H2O
本题解析:略
本题难度:一般
2、选择题 pH都为4的盐酸和NH4Cl溶液,向盐酸中加入amL水,向NH4Cl溶液中加入bmL水,结果两溶液的pH仍然相等。则a与b的关系正确的是()
A.a<b
B.a>b
C.a="b"
D.无法确定
参考答案:A
本题解析:盐酸是强电解质,HCl完全电离出H+和Cl-,加水只造成溶液的体积变大,而H+的物质的量不变,NH4Cl在溶液中存在水解平衡: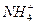 +H2O
+H2O NH3·H2O+H+。加水,使水解平衡右移,在体积增大的同时,H+的物质的量也增多,故应加入更多的水才能与盐酸的pH相同。
NH3·H2O+H+。加水,使水解平衡右移,在体积增大的同时,H+的物质的量也增多,故应加入更多的水才能与盐酸的pH相同。
本题难度:简单
3、选择题 向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
[? ]
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大
参考答案:A
本题解析:
本题难度:一般
4、选择题 25 ℃时,某NH4Cl溶液的pH为4,下列说法中不正确的是(? )
A.溶液中c(H+)>c(OH-)且c(H+)·c(OH-)=1×10-14
B.由水电离出来的c(H+)约为1×10-14 mol·L-1
C.溶液中c(Cl-)>c(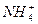 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.此溶液中水的电离度比纯水的电离度大
参考答案:B
本题解析:本题主要考查发生水解反应的盐溶液中水的电离平衡的移动及溶液中离子浓度大小的比较。在NH4Cl溶液中因: +H2O
+H2O NH3·H2O+H+而显酸性,常温下,稀溶液的KW保持不变,A正确;该溶液中c(H+)=1×10-4 mol·L-1,全部由水电离得到,故B不正确;NH4Cl溶液中
NH3·H2O+H+而显酸性,常温下,稀溶液的KW保持不变,A正确;该溶液中c(H+)=1×10-4 mol·L-1,全部由水电离得到,故B不正确;NH4Cl溶液中 水解,c(H+)>c(OH-),但
水解,c(H+)>c(OH-),但 水解程度不大,往水中加入能水解的盐,将使水的电离平衡向正反应方向移动,使水的电离程度增大,C、D正确。
水解程度不大,往水中加入能水解的盐,将使水的电离平衡向正反应方向移动,使水的电离程度增大,C、D正确。
本题难度:简单
5、选择题
A.c(A-)=c(K+)
B.c(H+)=c(OH-)<c(K+)<c(A+)
C.V总≥20 mL
D.V总≤20 mL
参考答案:AD
本题解析:本题考查的是一元酸的pH与强碱的pOH相等的两溶液反应达中性情况的相关知识的分析。要区分一元酸、碱两溶液物质的量浓度相同时混合反应的情况。分析溶液中阴、阳离子浓度间的关系要注重离子电荷守恒的应用。
溶液中四种离子浓度间满足电荷守恒关系:c(K+)+c(H+)=c(OH-)+c(A-)因为pH=7说明溶液中c(H+)=c(OH-),反应后的混合液中共存在四种离子,因此c(A-)=c(K+);如果HA是一元强酸,则V总="20" mL,如果是弱酸,则酸的浓度大于碱的浓度,V总<20 mL。
本题难度:简单