时间:2025-06-26 02:42:14
1、选择题 下列溶液一定呈碱性的是
A.pH=8的溶液
B.含有OH-离子的溶液
C.NaCl溶液
D.c(OH-)>c(H+)的溶液
参考答案:D
本题解析:A错误,没有告诉温度,不知道溶液离子积,无法计算。
B错误,水也能电离出氢氧根离子,但却是中性。
C错误,NaCl溶液呈中性。
D正确,氢氧根离子大于氢离子肯定是碱性溶液。
本题难度:一般
2、选择题 温室时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是(? ).
A.若pH>7时,则一定是c1v1=c2v2
B.在任何情况下都是c(Na+) + c(H+)=c(CH3COO-) + c(OH-)
C.当pH=7时,若V1=V2,则一定是c2>c1
D.若V1=V2, c1=c2,则c(CH3COO-) + c(CH3COOH)=c (Na+)
参考答案:A
本题解析:略
本题难度:一般
3、选择题 等物质的量浓度、等体积的下列溶液中:
①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3、⑤(NH4)2CO3,下列关系或者说法正确的是( )
A.c(CO32—)的大小关系为:②>⑤>③>④>①
B.c(HCO3—)的大小关系为:④>③>⑤>②>①
C.将溶液蒸干灼烧后只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
参考答案:A
本题解析:由于④中NH4+与HCO3—互相促进水解,故c(HCO3—):③>④,c(CO32—)也是③>④。B错;将各溶液蒸干灼烧后,①④⑤都分解为气体,C也错;Na2CO3只能与盐酸反应,而与NaOH溶液不反应,故D错;A项:NH4+与CO32—互相促进水解,故c(CO32—):②>⑤,HCO3—既水解又电离,水解程度大于电离程度,故③④中的c(CO32—)<②⑤中的c(CO32—),H2CO3是弱酸,二级电离常数很小,故H2CO3中的c(CO32—)最小。
本题难度:一般
4、选择题 常温下,将等体积、等物质的量浓度的NaOH溶液和CH3COOH溶液混合,混合液呈
A.中性
B.碱性
C.酸性
D.无法确定
参考答案:B
本题解析:等体积等浓度的氢氧化钠溶液和醋酸溶液混合,恰好中和生成醋酸钠,醋酸钠水解溶液呈碱性。
点评:理解盐类水解的本质:盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质,破坏水的电离平衡。
本题难度:一般
5、填空题 某同学想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色絮状沉淀,并且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式,并指出制取硫化铝的正确方法。
参考答案:Ⅰ?①增强②Fe2O3③减小减弱④溶液变红⑤生成无色气体,Mg片漂浮生成红褐色沉淀。
Ⅱ?在溶液中Al3+、S2-水解互相促进,发生剧烈水解。2Al3++3S2-+6H2O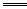 2Al(OH)3↓+3H2S↑H2S有臭鸡蛋气味。用S粉与Al粉(混合均匀)在干态时共热可制取Al2S32Al+3S
2Al(OH)3↓+3H2S↑H2S有臭鸡蛋气味。用S粉与Al粉(混合均匀)在干态时共热可制取Al2S32Al+3S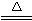 Al2S3
Al2S3
本题解析:Ⅰ?FeCl3溶液中存在下列平衡:
Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
加入NaOH中和H+,水解平衡右移。通入HCl(g)增大c(H+)使平衡左移,水解显酸性,滴入石蕊变红,加入MgCl2产生H2气泡,且平衡右移,生成Fe(OH)3沉淀。
蒸干FeCl3溶液,水解平衡右移,HCl挥发,生成Fe(OH)3沉淀,最后灼烧完全分解,所得固体为Fe2O3。
本题难度:简单