时间:2025-06-26 02:35:44
1、填空题 有H、D、T三种原子它们之间的关系是______.各1mol的H2、D2、T2三种单质中质子数之比是______;在标准状况下,1L各种单质中它们的电子数之比是______,在标准状况下它们的单质的密度之比是______.
参考答案:①H、D、T三种原子质子数相同,中子数不同,互称同位素;
②每个H2、D2、T2分子中含有的质子数都是2,物质的量相同的三种单质含有的分子数相同,含有的质子数相同,所以为:1:1:1.
③每个H2、D2、T2分子中含有的电子数都是2,相同条件下,体积相同的三种单质中含有的电子数相等,所以比为:1:1:1;
④密度公式为:ρ=mV=nMnVm=MVm,相同条件下,Vm相同,所以其密度之比等于其摩尔质量之比,为1:2:3;
故答案为:互称同位素; 1:1:1; 1:1:1;1:2:3;
本题解析:
本题难度:一般
2、简答题 下列各题中有关物质的比较,请用“>”、“<”、“=”填空:
(1)酸性:H3PO4______H2SO4,碱性:KOH______Mg(OH)2;
(2)氧化性:Cl2______S,还原性:Clˉ______Brˉ;
(3)稳定性:CH4______HF;
(4)微粒半径:Si______Na;Fˉ______Na+
(5)电子数目:H2O______CH4.
参考答案:(1)根据同周期元素从左到右元素最高价氧化物对应水合物的酸性逐渐减弱、碱性逐渐增强,可知:酸性H3PO4<H2SO4;碱性KOH>Mg(OH)2,故答案为:<;>;
(2)根据同周期元素从左到右元素单质氧化性逐渐增强,可知:氧化性Cl2>S;根据同主族元素从上到下元素阴离子的还原性逐渐增强,可知:还原性Clˉ>Brˉ,
故答案为:>;<;
(3)根据同周期元素从左到右元素氢化物稳定性逐渐增强,可知:CH4<HF,故答案为:<;
(4)根据同周期元素从左到右元素原子半径逐渐减小,可知:原子半径Si<Na;根据具有相同电子数的微粒核电荷数越大半径越小,可知:微粒半径Fˉ>Na+,故答案为:<;>;
(5)H2O、CH4均为10电子微粒,即二者电子数相等,故答案为:=.
本题解析:
本题难度:一般
3、选择题 将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是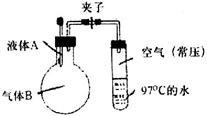
A.水、氯化氢
B.硫酸、氨气
C.氢氧化钠溶液、二氧化硫
D.氢氧化钠溶液、一氧化碳
参考答案:D
本题解析:将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,这是由于压强减小,沸点降低,因此分析选项中气体的压强减小、物质的量减小即可,以此来解答。A、HCl极易溶于水,压强减小,沸点降低,符合题意,故A不选;B、硫酸与氨气反应生成硫酸铵固体,压强减小,沸点降低,符合题意,故B不选;C、氢氧化钠溶液与二氧化硫反应生成亚硫酸钠溶液、水,压强减小,沸点降低,符合题意,故C不选;D、氢氧化钠溶液与一氧化碳不反应,不会导致压强减小,不符合题意,故D选,答案选D。
本题难度:一般
4、选择题 下列关于第二周期元素的说法正确的是
A.N2常温下很稳定,是因为N的电负性小
B.第二周期元素的第一电离能逐渐增大
C.第二周期元素除氖外电负性逐渐增大
D.氧原子半径小于氮原子半径,而氧离子半径大于氮离子半径
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列微粒半径比大于1的是( )
A.
| Mg2+ Mg |
| Cl Cl- |
| N O |
| Si Al |
参考答案:A.因同种元素的阳离子半径小于原子半径,则Mg2+/Mg小于1,故A错误;
B.因同种元素的阴离子半径大于原子半径,则Cl/Cl-小于1,故错误;
C.N、O都在同周期,同周期元素的原子半径从左向右在减小,则N/O大于1,故C正确;
D.Si、Al都在同周期,同周期元素的原子半径从左向右在减小,则Si/Al小于1,故D错误;
故选C.
本题解析:
本题难度:一般