时间:2025-06-26 02:34:06
1、填空题 回答下列有关常数的问题
(1)Kw的数学表达式是Kw=?,温度升高Kw的变化情况是?(选填“变大”、“变
小”或“不变”)。
(2)K通常表示化学平衡常数,K值越大表示该反应进行得越?,对于反应2NO2(g)  N2O4(g),其化学平衡常K的数学表达式为
N2O4(g),其化学平衡常K的数学表达式为 ,式中c2(NO2)表示的意义是?。
,式中c2(NO2)表示的意义是?。
(3)Ka通常表示弱酸的电离平衡常数,α通常称为电离度。对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Ka的变化情况是?(选填“变大”、“变小”或
“不变”),α的变化情况是?(选填“变大”、“变小”或“不变”)。
参考答案:
本题解析:略
本题难度:一般
2、选择题 下图是温度和压强对X+Y 2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A.X、Y、Z均为气态
B.恒容时,混合气体的密度可作为此反应是否达到化学平衡[的判断依据
C.升高温度时 增大,
增大, 减小,平衡向右移动
减小,平衡向右移动
D.使用催化剂Z的产率增加
参考答案:B
本题解析:根据图像可知,随着温度的升高,生成物Z的含量逐渐升高,所以反应是吸热反应。但升高温度,正逆反应速率均是增加的,C不正确。当温度相同时,压强越大,生成物Z的含量越小,这说明增大压强,平衡向逆反应方向移动,说明正反应是体积增大的反应。若X、Y、Z均为气态,则反应前后气体的体积不变,A不正确。所以Z一定是气体,X和Y中只能有一种是气体。密度是混合气的质量和容器容积的比值,反应过程中质量是变化的,所以当密度不再发生变化时,可以说明反应达到平衡状态,C正确。催化剂不能改变平衡状态,D不正确。答案是B。
本题难度:一般
3、选择题 下列说法正确的是
A.△H>0的反应,常温下一定不能自发进行
B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.恒容密闭容器中进行的反应3A(g) 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
参考答案:C
本题解析:A.由公式△G=△H—T△S可知,当△H>0时,常温下有可能自发进行(能保证△G小于0即可),错误
B.盐酸为强酸,酸性相对强,pH较醋酸小,错误
C.常温下,在0.1mol/L氨水中:NH3·H2O NH4++OH—,加入少量NH4Cl晶体,由于同离子效应,平衡左移,OH—浓度减小,溶液的pH减小,正确
NH4++OH—,加入少量NH4Cl晶体,由于同离子效应,平衡左移,OH—浓度减小,溶液的pH减小,正确
D.再充入一定量的A气体,相当于加压,平衡向气体系数减小(C为固体)的方向移动,A的转化率增大
故答案为C
本题难度:一般
4、选择题 关于可逆反应达到平衡的说法错误的是
A.外界条件不能改变平衡状态
B.正、逆反应速率相等
C.各组分的含量不随时间而变化
D.是动态平衡
参考答案:A
本题解析:
本题难度:困难
5、计算题 将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)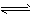 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量;
(2)B的平均反应速率;
(3)x值是多少?
参考答案:(1)0.75 mol/L;n(A)=n(B)=3 mol
(2)0.05 mol/(L·min)
(3)2
本题解析:
本题难度:一般