时间:2025-06-26 02:34:06
1、实验题 (11分)某研究性学习小组为证明2Fe3+ + 2I-  ?2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
?2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
按要求回答下列问题。
方案甲:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡。静置、分层,再取上层清液,滴加KSCN溶液。
(1)甲方案中能证明该反应为可逆反应的现象是?。
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是?。
方案乙:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到?现象,即可证明该反应为可逆反应,请解释产生该现象的原因?。
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向?方向偏转(填“左”、“右”或“不移动”),即可判断该反应为可逆反应,此时甲中石墨电极上的电极反应式为?。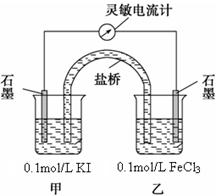
2、选择题 T℃时,A气体和B气体反应生成C气体。反应过程中A、B、C浓度变化如下图甲所示,若保持其它条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如下图乙所示,则下列结论正确的是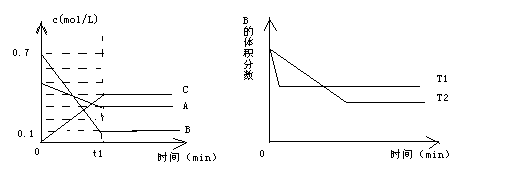
甲?乙
A.t1min时,保持其它条件不变,增大压强,平衡向逆反应方向移动?
B.t1min时,保持容器总体积不变,通入少量稀有气体,平衡向逆反应方向移动
C.其它条件不变时,升高温度,正、逆反应速率均增大,且A的转化率减小
D. T℃时,在相同容器中,若有1.0mol/L A、1.4mol/L B开始反应,达到平衡后,C的浓度等于0.8mol/L
3、填空题 (18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 ?(m-x)CeO2
?(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是?,该反应将太阳能转化为?。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为?。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= ?。
HCO3-+OH-的平衡常熟Kh= ?。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
①电解过程中发生反应的离子方程式是?,阴极附近溶液PH?(填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的?。
a.Ba(OH)2 ?b.Ba(NO3)2? c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式?。
③图中氢氧化钠溶液的质量分数a%?b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为?。
4、选择题 在一定条件下,在密闭容器中反应:2NO2(g)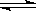 O2(g)+ 2NO(g) ΔH>0,达到
O2(g)+ 2NO(g) ΔH>0,达到 平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是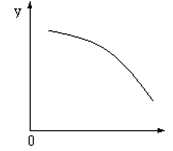
A.当X表示温度时,Y表示NO的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
5、选择题 在10℃时某化学反应速率为0.1mol·L-1·s-1,若温度每升高10℃反应速率增加为原来的2倍,为了把反应速率提高到1.6 mol·L-1·s-1,则该反应需在什么温度下进行
[? ]
A.30℃
B.40℃
C.50℃
D.60℃