时间:2025-06-26 02:32:27
1、实验题 某同学想利用原电池反应检测Zn和Cu的金属活动性顺序。请你帮他选择适宜的材料和试剂设计一个原电池,并完成下列实验报告:
实验目的:探究Zn和Cu的金属活动性顺序
(1)电极 材料:正极:?;负极:??;
电解质溶液:?。
(2)写出电极反应式:
正极:??;负极:??。
(3)实验现象:?
(4)实验结论:?
参考答案:(1)铜片、锌片 ;? CuSO 4溶液(可有其他答案)
(2)正极:Cu2+ + 2e- = Cu?负极:Zn –2e- = Zn2+
(3)负极不断溶解,正极上有红色固体析出,溶液蓝色变浅
(4)金属活动性Zn>Cu
本题解析:(1)中,由于锌比铜活泼,所以组成的电池的电极材料为铜为正极,锌为负极,电解质溶液为CuSO 4溶液(可有其他答案);(2)电极反应式为正极:Cu2+ + 2e- = Cu ,负极为Zn –2e- = Zn2+;(3)该原电池中,锌极作为负极,不断地溶解,而铜离子则是在正极析出,因为铜离子为蓝色,所以溶液变浅,即该实验现象为负极不断溶解,正极上有红色固体析出,溶液蓝色变浅;(4)实验结论锌与铜的金属活动性大小为Zn>Cu。
点评:本题考查了原电池的实验,通过设计实验比较锌和铜的金属活动性,实验题的考查历年是高考考查的重点和难度,本题难度适中。
本题难度:一般
2、选择题 如图为原电池示意图,下列说法正确的是( )
A.锌片是正极,铜片是负极
B.硫酸的浓度不变
C.该装置能够将电能转化为化学能
D.电子由锌片通过导线流向铜片
参考答案:A、锌片是负极,铜片是正极,故A错误;
B、溶液中氢离子减少,硫酸浓度减小,故B错误;
C、该装置能够将化学能转化为电能,故C错误;
D、电子由锌片通过导线流向铜片,故D正确;
故选D.
本题解析:
本题难度:一般
3、填空题 (14分)铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
①该电池的总反应化学方程式为 ;
②电池中NaCl的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
参考答案:(14分)(1)第三周期第ⅢA族(2分)
(2)①4Al+3O2+6H2O=4Al(OH)3 (2分) ②增强溶液的导电能力(2分)
③I-+3H2O-6e-=IO3-+6H+ (2分) ④2.7g (2分)
(3) ①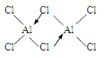 (2分)②Al2O3+3C+3Cl2
(2分)②Al2O3+3C+3Cl2 2AlCl3+3CO.(2分)
2AlCl3+3CO.(2分)
本题解析:(1)13号元素铝元素原子的核外电子排布是2、8、3,其在元素周期表中的位置是第三周期第ⅢA族;(2)在负极发生反应:4Al-12e-=4Al3+;在正极发生反应:3O2+6H2O+12e-+4Al3+=4Al(OH)3。总反应方程式是4Al+3O2+6H2O=4Al(OH)3。②电池中NaCl的作用是电解质,提供自由移动的离子,增强溶液的导电能力;③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料),溶液中的阴离子放电,由于放电能力:I->OH-,所以I-在阳极放电,阳极的电极反应式为I-+3H2O-6e-=IO3-+6H+;④NaCl溶液电解的方程式是:2NaCl+2H2O Cl2↑+H2↑+2NaOH,每产生2mol的NaOH,转移2mol的电子,n(NaOH)=0.3 mol/L×0.5L=0.15mol,铝一空气电池的效率为50%,所以转移电子的物质的量是0.15mol÷50%=0.30mol,Al是+3价的金属,所以反应消耗的Al的物质的量是0.30mol÷3=0.10mol,其质量是m(Al)= 0.10mol×27g/mol=2.7g;(3)①氯化铝在加热条件下易升华,说明该物质是分子晶体,在气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为
Cl2↑+H2↑+2NaOH,每产生2mol的NaOH,转移2mol的电子,n(NaOH)=0.3 mol/L×0.5L=0.15mol,铝一空气电池的效率为50%,所以转移电子的物质的量是0.15mol÷50%=0.30mol,Al是+3价的金属,所以反应消耗的Al的物质的量是0.30mol÷3=0.10mol,其质量是m(Al)= 0.10mol×27g/mol=2.7g;(3)①氯化铝在加热条件下易升华,说明该物质是分子晶体,在气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为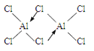 ;②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,根据元素守恒及电子守恒可得该反应的化学方程式是Al2O3+3C+3Cl2
;②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,根据元素守恒及电子守恒可得该反应的化学方程式是Al2O3+3C+3Cl2 2AlCl3+3CO。
2AlCl3+3CO。
考点:考查元素在周期表中的位置、原电池、电解池反应原理及应用、物质结构式、反应方程式的书写的知识。
本题难度:困难
4、选择题 某原电池总反应离子方程式为2Fe3++Fe=3Fe2+能实现该反应的原电池是( )
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为铜,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3
D.正极为银,负极为铁,电解质溶液为CuSO4
参考答案:A、铁的活泼性大于铜,铁作负极,铜作正极,电解质溶液为氯化铁,所以是能实现该反应的原电池,故A正确;
B、铁的活泼性大于铜,铁作负极,铜作正极,电解质溶液为硝酸铁,所以是能实现该反应的原电池,故B正确;
C、锌的活泼性大于铁,锌作负极,铁作正极,电解质溶液为硫酸铁,所以是不能实现该反应的原电池,故C错误;
D、铁的活泼性大于银,铁作负极,银作正极,电解质溶液为硫酸铜,所以是不能实现该反应的原电池,故D错误;
故选AB.
本题解析:
本题难度:一般
5、选择题 通过NOx传感器可监测NOx的含量,其工作原理示意图如下: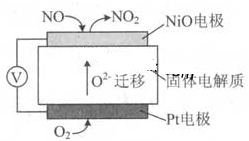
下列说法正确的是 (?)
A.NiO 电极是该电池的正极
B.Pt电极附近的pH 增大
C.NiO 电极的电极反应式:NO—2e—+O2—=NO2
D.固体电解质中O2-向正极移动
参考答案:C
本题解析:A、NiO 电极NO失去电子生成NO2,为负极,错误;B、Pt电极氧气得到电子生成O2-,与酸碱性无关,错误;C、正确;D、原电池中负离子向负极移动,错误。
本题难度:一般