时间:2025-06-26 02:32:27
1、选择题 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。关于该电池的说法正确的是( )
A.钢板为正极,发生还原反应
B.放电时电子的流向:正极→导线→负极
C.放电时OH-向正极移动
D.总反应为:2Li+2H+ 2Li++H2↑
2Li++H2↑
参考答案:A
本题解析:电极反应为(—)2Li-2e- 2Li+,(+)2H2O+2e-
2Li+,(+)2H2O+2e- 2OH-+H2↑,故钢板为正极,发生还原反应,A正确;原电池电子的流向:负极→导线→正极,B错误;原电池阴离子向负极移动,C错误;锂水电池的总反应为2Li+2H2O
2OH-+H2↑,故钢板为正极,发生还原反应,A正确;原电池电子的流向:负极→导线→正极,B错误;原电池阴离子向负极移动,C错误;锂水电池的总反应为2Li+2H2O 2LiOH+H2↑,D错误。
2LiOH+H2↑,D错误。
本题难度:一般
2、填空题 由锌片、铜片和稀盐酸组成的原电池,正极的电极反应是_____________________,负极的电极反应是
___________________,原电池的总反应是______________________。
参考答案:2H++2e-=H2↑;Zn-2e-=Zn2+;Zn+2H+=Zn2++H2↑
本题解析:
本题难度:一般
3、选择题 原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、NaCl溶液组成原电池,其负极反应式为:Cu - 2e-= Cu2+
D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗Cu电极32g
参考答案:C
本题解析:试题分析:A.由Al、Cu、稀H2SO4组成原电池,Al为负极,放电时SO42-向Al电极移动,A正确。B.由Mg、Al、NaOH溶液组成原电池,Al为负极失电子氧化反应:Al-3e-+4OH-=AlO2-+2H2O,B正确。C.由Fe、Cu、NaCl溶液组成原电池,Fe为负极,负极反应式为:Fe-2e-=Fe 2+,C不正确。D.由Al、Cu、浓硝酸组成原电池中铝钝化作正极,铜作负极电极反应为Cu-2e-=Cu 2+;电解硝酸银溶液,当析出1 mol Ag时,电路中转移1 mol电子,消耗Cu 0.5mol为32g,D正确。
考点:了解原电池、电解池工作原理,能写出电极反应和电池反应方程式,会进行简单计算。
点评:原电池中电极的判断不仅与电极材料的性质有关如活泼性、是否发生钝化等,也与电解质溶液有关如酸溶液、碱溶液、强氧化性溶液等;复杂电路中的有关计算常利用电子守恒的思想解决。
本题难度:一般
4、选择题 如下图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化):(? )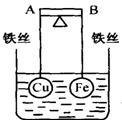
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
参考答案:D
本题解析:若为绝缘体,则铁直接和硫酸铜发生置换反应,铜析出附着在铁上,质量增加,所以A端高,B端低。若为导体,则构成原电池,其中铁是负极,铜是正极,铜离子在正极得到电子析出,因此是A端低,B端高。答案选D。
本题难度:一般
5、选择题 由铜、锌和稀硫酸组成的原电池,在工作过程中,电解质溶液的pH
[? ]
A.不变
B.先变小后变大
C.逐渐变大
D.逐渐变小
参考答案:D
本题解析:
本题难度:一般