时间:2025-06-26 02:30:48
1、填空题 (10分)铁元素的化合价有+2、+3两种,磁铁矿的主要成分是Fe3O4,能与盐酸反应生成两种盐。
(1)请用铁的+2价、+3价的氧化物形式表示Fe3O4可写成___________________
(2)写出Fe3O4与盐酸反应的离子方程式_________________。
(3)设计实验验证反应后溶液中含有Fe3+所用的试剂和反应的化学方程式__________、______________。
(4)设计实验验证反应后溶液中不含Fe3+而可能含有Fe2+。进行实验操作的顺序有:①加入足量氯水,②加入足量高锰酸钾溶液,③加入少量硫氰化钾溶液,选择所需要的试剂及先后的顺序是______________(注意先后顺序)。
(5)将反应后的溶液中Fe3+全部转化为Fe2+,最适宜的物质是选用___________。
(6)将反应后的溶液中Fe2+全部转化为Fe3+,选用的绿色试剂是H2O2 ,H2O2在酸性的条件下将Fe2+氧化为Fe3+,写出反应的离子方程式___________________。
2、填空题 由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下: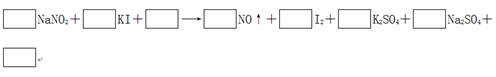 ?
?
(1)请完成并配平该化学方程式。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
________________________________________________________________________。
从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。
3、选择题 火法炼铜的原理为:Cu2S + O2?="==" 2Cu + SO2,下列说法中,正确的是
A.Cu2S 只做还原剂
B.O2发生氧化反应
C.S元素被氧化
D.当0.8mol O2参加反应时,共转移了3.2mol电子
4、选择题 下列离子方程式表示的是氧化还原反应的是
[? ]
A.HCO3-+OH-==CO32-+H2O
B.2Fe3++Fe=3Fe2+
C.H3PO4+3OH-=PO43-+3H2O
D.Zn+2H+=Zn2++H2↑
5、选择题 下列叙述正确的是(?)
A. 具有还原性,故可作漂白剂
具有还原性,故可作漂白剂
B. 的金属活性比
的金属活性比 强,故可用
强,故可用 与
与 溶液反应制
溶液反应制
C.浓硝酸中的 见光分解,故有时在实验室看到的浓硝酸呈黄色
见光分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在 中燃烧生成
中燃烧生成 ,故在与其他非金属反应的产物中的Fe也显+3价
,故在与其他非金属反应的产物中的Fe也显+3价