时间:2025-06-26 02:15:28
1、选择题 X盐和Y酸反应,可放出有气味的气体Z;Z跟NaOH溶液反应又得到X;Z氧化的最终产物为W ,W溶于水又得到Y,则X和Y是
A.Na2S和H2SO4
B.Na2SO3和盐酸
C.Na2S和盐酸
D.Na2CO3和H2SO4
参考答案:A
本题解析:略
本题难度:简单
2、填空题 (10分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):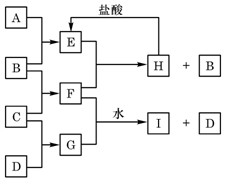
请填写下列空白:
(1)A?,C是?。
(2)H与盐酸反应生成E的化学方程式是?。
(3)E与F反应的化学方程式是?。
(4)F与G的水溶液反应生成I和D的离子方程式是??
参考答案:(13分)
(1)A:碳(或C)? C:钠(或Na)? (2)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(3)2CO2+2Na2O2=2Na2CO3+O2?(4)Na2O2+S2-+2H2O=4OH-+S↓+2Na+
本题解析:综合考虑可知B、E分别O2、CO2,进而可知A为C;F的焰色反应呈黄色,可推得C为Na,F为Na2O2;而G中,非金属元素与金属元素钠的原子个数比为1∶2,可推得D元素为硫。
(4)Na2O2与Na2S在水中反应产生硫单质,即硫被氧化,同时钠只能以NaOH物质存在
本题难度:一般
3、选择题 (17分)A、B、C、D、E五种元素原子序数依次增大,除E外均为短周期主族元素,B、C、D同周期,A、D同主族。A的最外层有三个未成对的电子,B是同周期第一电离能最小的元素,C的原子结构示意图为:?,E的价层电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _______? B_______? C _______? D _______
(2)用元素符号表示A、C、D电负性由小到大的顺序____________。
(3)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是_____。
(4) D的氢化物比A的氢化物的沸点_____(填"高"或"低"),A的氢化物分子立体构型为________。
(5) E元素在周期表的位置是______________。
(6) B、C、D最高价氧化物的晶体类型是分别是______、________、______。
参考答案:(1) N? Na ?Si?P?(2) Si<P<N?(3) HNO3?(4) 低,三角锥形?
(5)第四周期VIII族?(6)离子晶体、原子晶体、分子晶体
本题解析:考查元素原子的电子排布规律即元素周期表和元素周期律。
(1)C的原子结构示意图为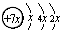 ,所以x=2,即C是硅元素。B、C、D同周期,A、D同主族,因此A是第二周期元素。A的最外层有三个未成对的电子,所以A是氮元素,则D是磷元素。金属性越强,电离能越小,所以B是第三周期的钠元素。根据E的价层电子排布式3d64s2并结合构造原理可得出E是铁元素。
,所以x=2,即C是硅元素。B、C、D同周期,A、D同主族,因此A是第二周期元素。A的最外层有三个未成对的电子,所以A是氮元素,则D是磷元素。金属性越强,电离能越小,所以B是第三周期的钠元素。根据E的价层电子排布式3d64s2并结合构造原理可得出E是铁元素。
(2)非金属性越强,电负性越大,非金属性是Si<P<N,则电负性也Si<P<N。
(3)非金属性越强,最高价氧化物对应水化物的酸性越强。
(4)氨气中存在氢键,所以其沸点高于PH3的。
(5)铁属于第四周期第VIII族。
(6)B、C、D最高价氧化物分别是Na2O、SiO2、P2O5,其晶体类型分别是离子晶体、原子晶体、分子晶体。
本题难度:一般
4、推断题 A.J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;?F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。? 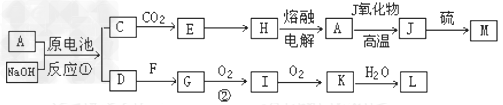
请回答以下问题:? ?
(1)写出原电池的负极反应方程式________________
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为_____________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者___________?后者(用“>”、“<”或“=”表示)。 ?
(3)写出②的化学方程式_____________?
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色的钴玻璃观察火焰呈紫色。
①X的水溶液与NaHCO3溶液混合,反应的离子方程式为_________
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图:? 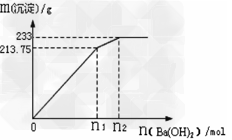
请回答:X晶体的俗名为___________;其溶液的物质的量浓度为__________?mol/L。
参考答案:(1)Al+4OH--3e- = AlO2-+2H2O?
(2)10-2-10-12 mol/L或c(OH-)-c(H+)?;<?
(3)4NH3+5O2 4NO+6H2O?
4NO+6H2O?
(4)①Al3++3HCO3- = Al(OH)3↓+3CO2↑? ;? ②明矾 ;1mol/L
本题解析:
本题难度:一般
5、填空题 (10分)下列是中学常见的一些物质之间的转化关系(其中部分反应产物省略),其中I是一种金属单质,A是一种黄绿色的非金属单质;F、M、N均为难溶于水的白色沉淀物质,M和N不溶于稀硝酸;B是一种具有刺激性气味的气体,且具有漂白性;C和D是中学化学中两种常见的强酸。请回答下列问题: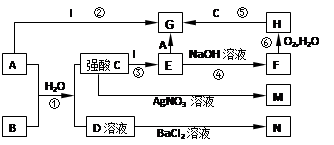
(1)写出物质B和M的化学式:B.??,? M.??;
(2)写出E→G转化反应的离子方程式:??;
(3)写出反应⑥的化学方程式:??;
(4)写出反应⑤的离子方程式: ??。
参考答案:(共10分)(1)(4分)SO2;AgCl?(2)(2分)2 Fe2+ +Cl2 ?=" 2" Fe3+ + 2Cl-;
(3)(2分)4Fe(OH)2+O2+2H2O=4Fe(OH)3?(4) (2分) Fe(OH)3?+ 3H+ = Fe3+ + 3H2O
本题解析:A是一种黄绿色的非金属单质,则A是氯气。B是一种具有刺激性气味的气体,且具有漂白性,氯气还能和B反应,所以B是SO2。根据反应④和⑥可知,F应该是氢氧化亚铁,H是氢氧化铁,所以I是铁,则G是氯化铁。又因为氯气和SO2在水溶液中反应生成盐酸和硫酸,因此C是盐酸,D是硫酸,E是氯化亚铁,M是氯化银,N是硫酸钡。2性质为载体无机框图题的推断
点评:该题是高考中的常见题型,试题贴近高考,难易适中,综合性强,有助于培养学生的逻辑思维能力和发散思维能力。化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般