时间:2025-06-26 02:15:28
1、填空题 (9分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。 (1)W的第一电离能比氧原子的?(填“大”或“小”),W的气态氢化物稳定性比
(1)W的第一电离能比氧原子的?(填“大”或“小”),W的气态氢化物稳定性比 H2O(g) ?(填“强”或“弱”),W的单质分子中含?个∏键;
H2O(g) ?(填“强”或“弱”),W的单质分子中含?个∏键; (2)Z位于元素周期表第?周期第?族,Z的基态原子核外电子排布式是?;
(2)Z位于元素周期表第?周期第?族,Z的基态原子核外电子排布式是?; (3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
(3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
?。
参考答案: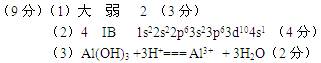
本题解析:略
本题难度:一般
2、实验题 (15分)某强酸性溶液X中含有Ba2+、A l3+、NH4+、Fe2+、Fe3+、CO32—、SO32—、SO42 —、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下: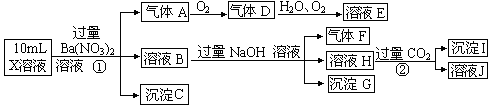
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还一定含有的离子是____________________,不能确定的阳离子是___________,若要用实验证明该离子一定不存在,其最可靠的化学方法是________________________________________________________。
(2)沉淀G的化学式为_____________。
(3)写出下列反应的离子方程式:
①中生成气体A:_______________________________________。
②生成沉淀I:_______________________________________________。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是_________,沉淀C物质的量___________。
参考答案:(1)Al3+、NH4+、Fe2+、SO42—?(2分)? Fe3+?(1分) 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+(其它合理答案也可)。(2分)
(2)Fe(OH)3?(2分)
(3) ① 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O?(2分)
②AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-?(2分)
(4) Fe3 +?>0.07mol (或Cl-?<0.07mol ) (各2分)
本题解析:略
本题难度:困难
3、填空题 (8分)物质间有下列转代关系: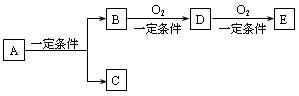
(1)若C是可用于自来水消毒的气体,D、E是氧化物,D转化为E时增加氧的质量是D的质量的25.8%,则A是?(写化学式)并写出A在一定条件下生成的C的化学方程式?。
(2)若E是酸酐,且为无色易挥发的晶体,A为气态氢化物,则A与D反应生成B的化学方程式为?。
(3)若C是水,B是无氧化合物,B在同系物中是相对分子质量最小的化合物;工业上用B与C在催化剂条件下制取A,A为常见的一种燃料。E能使紫色石蕊试液显红色,则由D生成E的反应类型为? ?。A、B、D、E中能与水形成氢键而易溶于水的是?(写结构简式)
参考答案:
(1)NaCl(1分)、2NaCl 2Na+Cl2
2Na+Cl2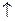 (2分)
(2分)
(2)?2H2S+SO2=3S+2H2O(2分)
(3)氧化反应(1分)、CH3CH2OH? CH3COOH或CH3CHO(多选无分)(2分)
本题解析:略
本题难度:简单
4、填空题 已知:下列各种物质都由1~18号元素组成,它们之间的关系如下图所示.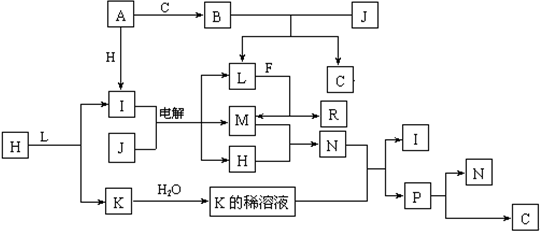
常温下,A、F为金属单质,J是常见无色液体,F既能与L溶液反应,又能与N溶液反应.C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R的焰色反应均呈黄色.R的水溶液中滴加盐酸时,刚开始有白色沉淀,后来沉淀又逐渐溶解.请回答:
(1)请写出A与C反应生成B的化学方程式______
(2)P不稳定光照易分解成N和C,该反应的化学方程式为______
(3)请写出上述电解反应的离子方程式______
(4)R与足量盐酸反应的化学方程式为______.
参考答案:H呈黄绿色,应为Cl2,A、B、I、K、L、R的焰色反应均呈黄色,均含有Na元素,则金属A为Na,与氯气反应生成I为NaCl,钠与气体C反应生成B,B与常见无色液体J反应生成C,可推知J为H2O、C为O2,B为Na2O2,L为NaOH,电解J、I的反应为电解饱和食盐水,则M为H2,金属F与L(NaOH)反应得到R与M(氢气),则F为Al,R为NaAlO2.M(氢气)与H(氯气)反应得到N为HCl,H(氯气)与L(NaOH)反应生成氯化钠、次氯酸钠与水,则K为NaClO,与盐酸反应的I(NaCl)与P,则P为HClO,HClO分解可以得到HCl与氧气,
(1)A与C反应生成B是氧气与钠反应生成过氧化钠,反应方程式为:2Na+O2△.Na2O2,
故答案为:2Na+O2△.Na2O2;
(2)HClO不稳定光照易分解成HCl和氧气,该反应的化学方程式为:2HClO=2HCl+O2↑,
故答案为:2HClO=2HCl+O2↑;
(3)电解饱和食盐水生成氢气、氯气与氢氧化钠,反应的离子方程式为:2H2O+2Cl?电解.2OH?+H2↑+Cl2↑,
故答案为:2H2O+2Cl?电解.2OH?+H2↑+Cl2↑;
(4)偏铝酸钠与足量盐酸反应生成氯化钠、氯化铝与水,化学反应方程式为:NaAlO2+4HCl=AlCl3+NaCl+2H2O,
故答案为:NaAlO2+4HCl=AlCl3+NaCl+2H2O.
本题解析:
本题难度:一般
5、填空题 (11分) 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如右图所示。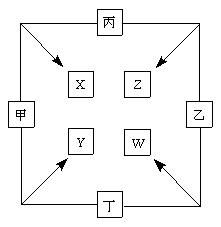
已知:
①?甲、乙、丙均为前三周期元素的单质,常温下均为气体,丁是日常生活中的一种常见金属。
②?常温下,X是无色液体,Y是黑色固体。
③?丙在乙中燃烧发出苍白色的 火焰,W的水溶液呈黄色。
火焰,W的水溶液呈黄色。
请回答:
(1)写化学式:甲_____________, Z_____________。
(2)丁与X在高温下也能得到Y,请写出该反应的化学方程式
___________________________________________________。
(3)将少量W的溶液滴入几滴KSCN溶液,迅速变为红色,请写出该反应的化学方程式____________________________________________________。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H,将H滴入品红后,溶液的颜色逐渐褪去,加热后溶液为?(填颜色)。
(5)将Y恰好溶于Z的水溶液后,检验其中低价金属离子的方法是滴入酸性KMnO4,紫色褪去,说明有该离子,仔细分析后发现该结论存在缺陷,此“缺陷”是?。
参考答案:(1) O2,HCl? (2) 3Fe + 4H2O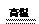 Fe3O4 + 4H2
Fe3O4 + 4H2
(3) Fe3++ 3SCN-= Fe(SCN)3? (4) 无色
(5) 在酸性条件下,Cl-也能将MnO4-还原,使其褪色
本题解析:(1)无机推断题,要找准“题眼”,本题中③可作为切入点,丙在乙中燃烧发出苍白色的 火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4
火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4
(2)丁与X在高温下也能得到Y的化学方程式为3Fe + 4H2O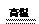 Fe3O4 + 4H2
Fe3O4 + 4H2
(3)Fe3+遇SCN-显红色,可以用来检验Fe3+,离子方程式为Fe3++ 3SCN-= Fe(SCN)3。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H2O2,H2O2具有强氧化性,能使品红褪色,加热,不能恢复,所以溶液最终无色。
(5)酸性KMnO4可以氧化Fe2+,同时也能氧化Cl-。所以酸性KMnO4紫色褪去,不能验证溶液中一定存在Fe2+。
本题难度:简单