时间:2025-06-26 02:15:28
1、选择题 X、Y、Z是由短周期元素组成的单质,甲、乙是常见的化合物,已知有如下反应:①X + Z→乙;②Y+Z→甲;③X+甲→Y+乙。下列叙述正确的是
A.甲中不含组成X的元素,乙中不含组成Y的元素
B.单质X一定是金属
C.X、Y、Z不可能都是非金属单质
D.如果Y是氢,X是铝,则甲是AlCl3
参考答案:
A
本题解析:略
本题难度:一般
2、选择题 由短周期元素组成的中学常见无机物A、B、C、D、E、? X存在如下图转化关系(部分生成物和反应条件略去).下? 列推断不正确的是? 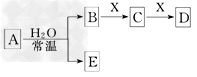
[?]
A.若X是Na2CO3,C为含极性键的分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3-===H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A的电子式是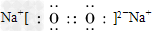
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
参考答案:A
本题解析:
本题难度:一般
3、填空题 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示。又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属。②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色。回答下列问题: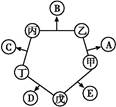
(1)A与B可反应,产物中阳离子的结构式为?。
(2)A与B的沸点比较,较高的是?(写化学式)。
(3)E的水溶液可使KI淀粉溶液变蓝,写出该反应的离子方程式:?。
(4)工业上可由B与丁反应制取C,写出该反应的化学方程式:?。
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式:?。
(6)用以上金属戊作电极,利用如图装置,可以模拟金属的电化学防护。若X为碳棒,为减缓戊的腐蚀,开关K应置于?处。若X为锌,开关K置于M处,该电化学防护法称为?。
参考答案:(1)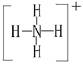 (2)NH3
(2)NH3
(3)2Fe3++2I- 2Fe2++I2
2Fe2++I2
(4)4NH3+5O2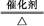 4NO+6H2O
4NO+6H2O
(5)2Fe3++3Cl2+16OH- 2Fe
2Fe +6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH-
+6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH- 2Fe
2Fe +6Cl-+8H2O]
+6Cl-+8H2O]
(6)N 牺牲阳极的阴极保护法
本题解析:根据图示和②乙在甲中燃烧发出苍白色火焰,则甲为Cl2,乙为H2,A为HCl。又因E的水溶液呈黄色,则E中应含Fe3+,即戊为Fe,E为FeCl3。又因丙、丁是空气的主要成分,即为N2和O2中的一种,再根据转化关系图,丁与戊(Fe)反应,故丁为O2,则丙为N2,B为NH3,C为NO,D为Fe2O3或Fe3O4。(1)A(HCl)与B(NH3)反应生成NH4Cl,N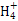 的结构式为
的结构式为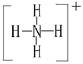 。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I-
。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I- 2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2
2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2 4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe
4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe ,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH-
,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH- 2Fe
2Fe +6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH-
+6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH- 2Fe
2Fe +6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
+6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
本题难度:一般
4、填空题 有A、B、C、D四种无色气体,
①A能使湿润的红色石蕊试纸变蓝;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;
③D与A混合生成白烟;
④D的浓溶液与软锰矿(主要成分是MnO2)在加热条件下反应可制取黄绿色气体E;按要求回答下列问题:
(1)写出②化学方程式______;
(2)写出④的离子方程式______;
(3)气体E有毒,实验室一般用______吸收,该反应的离子方程式是______.
参考答案:①A能使湿润的红色石蕊试纸变蓝;是氨气的特征性质,判断为NH3;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;红棕色气体为NO2,判断C为NO,
④D的浓溶液与软锰矿(主要成分是MnO2)在加热条件下反应可制取黄绿色气体E;推断D为浓盐酸,黄绿色气体E为Cl2;
③D与A混合生成白烟;说明A为NH3,B为O2,;
综上所述判断出的物质为:A为NH3;B为O2;C为NO;D为HCl;E为Cl2;
(1)反应②是氨气的催化氧化生成一氧化氮和水,一氧化氮和空气中氧气反应生成红棕色气体二氧化氮,反应的化学方程式为:4NH3+5O2催化剂.△4NO+6H2O;2NO+O2=2NO2
故答案为:4NH3+5O2催化剂.△4NO+6H2O;2NO+O2=2NO2;
(2)反应④是实验室制备氯气的反应生成氯化镁、氯气、水,反应的离子方程式为:MnO2+4H+?△?.?Mn2++Cl2↑+2H2O;故答案为:MnO2+2Cl-+4H+?△?.?Mn2++Cl2↑+2H2O;
(3)气体E为氯气有毒不能排放到空气中污染环境,需要用氢氧化钠溶液吸收,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;故答案为:NaOH溶液;Cl2+2OH-=Cl-+ClO-+H2O;
本题解析:
本题难度:一般
5、选择题 下图所涉及的物质均为中学化学中的常见物 质,它们存在如下转化关系:
质,它们存在如下转化关系: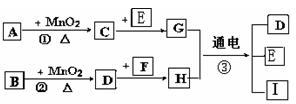
其中(1)C、D、E、F都为单质,其余为化合物(2)C、D、E 在常温下为气体,G为液体
(3)A、I 两种化合物的焰色反应均为紫色
(4)反应①②的一些生成物已经略去,有些反应的条件未列出
(1)写出有关物质的化学式:
A?, I?。
(2)指出MnO2在相关反应中的作用:反应 ① 中是?剂,反应 ② 中是?剂。
(3)写出反应②化学方程式,并标出电子转移的方向和数目? ______?。
(4)写出反应③的离子方程式_______ _______________________
_______________________
参考答案:(1) KClO3 ,KOH
(2)催化剂,氧化剂
(3)略
(4)略
本题解析:略
本题难度:简单