时间:2025-06-26 01:55:52
1、选择题 有关化学用语正确的是( )
A.乙烯的最简式C2H4
B.乙醇的结构简式C2H6O
C.四氯化碳的电子式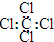
D.臭氧的分子式O3
2、选择题 下列事实能证明氯化氢是共价化合物的是(?)
A.氯化氢易溶于水
B.氯化氢水溶液能导电
C.液态氯化氢不导电
D.氯化氢不易分解
3、选择题 NaF、NaI、MgO均为离子化合物,根据下列数据,这三种化合物的熔点高低顺序是:
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 核间距/10—10m | 2.31 | 3.18 | 2.10 |
4、选择题 美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构--Al13和Al14.?已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是
[? ]
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al14最外层电子数之和为42,与第ⅡA族元素原子的性质相似
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
5、填空题 写出下列微粒的电子式:
(1)有14个电子的双原子分子______。
(2)有14个电子具漂白性的含氧酸分子____。
(3)铵离子______。