时间:2025-06-26 01:55:52
1、选择题 下列有关化学用语表示正确的是
[? ]
A.乙烯的结构简式:C2H4
B.邻羟基苯甲酸的结构简式: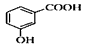
C.次氯酸的电子式: 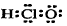
D.质子数为53,中子数为78的碘原子:13153I
2、填空题 铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素。
(1)铁、钴、镍都是很好的配位化合物形成体。
①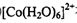 在过量氨水中易转化为
在过量氨水中易转化为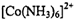 。写出
。写出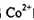 的价层电子排布图____。
的价层电子排布图____。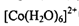 ?中
?中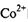 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。
H2O分子的立体构型为__________。
②铁、镍易与一氧化碳作用形成羰基配合物,如: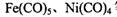 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中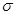 键和
键和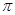 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价。NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO____FeO(选填“<”“>”“=”); 某种天然Nio晶体存在如图所示缺陷:一个Niz+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈屯中性。某氧化镍样品组成为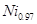 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。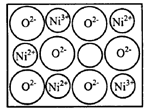
3、填空题 有一组物质:①NaOH、②H2O、③MgBr2 、④CO2、⑤H2、⑥N2、⑦Na2O2、 ⑧H2O2、⑨NH4Cl、⑩SO2?
(1) 离子化合物有___________ 共价化合物有________________ ,既含有离子键又含有共价键的物质有_________________
(2)写出下列物质的电子式:
H2O____________ MgBr2_____________ CO2___________ Na2O2____________________
4、选择题 目前,科学家拟合成一种“二重构造”的球形分子,即把“足球型”的C60溶进“足球型”的Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种分子的说法中,错误的是
A.是两种单质组成的混合物
B.晶体属于分子晶体?
C.是一种新型化合物?
D.相对分子质量为2400
5、选择题 下列过程中,共价键被破坏的是( )
A.碘升华
B.酒精溶于水
C.冰融化成水
D.HCl气体溶于水