时间:2025-06-26 01:33:46
1、填空题 (11分)应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) △H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H = -566.0 kJ/mol
H2O(g)=H2O(1) △H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H=" +" 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H=" +" 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
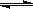 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。参考答案:(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =" -442.8" kJ/mol(3分)
(2) > (2分) (3) ①< (2分) >(2分) ② 90%(2分)
本题解析:(1)根据盖斯定律,将已知反应(①-②+③×4)÷2得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=[(-1275.6kJ/mol)-(-566.0kJ/mol)-(-44.0kJ/mol)×4]÷2=442.8kJ?mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1。
(2)由表中数据可知,平衡时时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=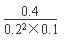 =100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆。
=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆。
(3)①平衡:2A(g)+B(g) 2C(g),是一个反应后气体系数和减小的反应,所以恒容容器下,反应达到平衡状态,恒压容器中随反应进行,为保持恒压,压强增大,达到平衡所需时间少,平衡正向移动,CO2的体积分数增大,CO2的体积分数关系是,恒压容器I大于恒容容器。
2C(g),是一个反应后气体系数和减小的反应,所以恒容容器下,反应达到平衡状态,恒压容器中随反应进行,为保持恒压,压强增大,达到平衡所需时间少,平衡正向移动,CO2的体积分数增大,CO2的体积分数关系是,恒压容器I大于恒容容器。
②在500℃时,分别将2mol A和1mol B置于恒容容器Ⅱ中(两容器起始容积都为10L),设A消耗物质的量为x 2A(g)+B(g) 2C(g)
2C(g)
起始量(mol) 2 1 0
变化量(mol) x 0.5 x x
平衡量(mol) 2-x 1-0.5x x
容器Ⅱ中的压强减小了30%,气体物质的量减小30%
3-3×30%=2-x+1-0.5x+x
X=1.8mol
A的转化率=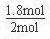 ×100%=90%。
×100%=90%。
考点:考查盖斯定律的应用、化学平衡计算以及外界条件对平衡状态的影响等
本题难度:困难
2、填空题 I.已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
(1)写出可逆反应一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式:________________。
(2)写出CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数表达式:__________,若某温度时K=1,某时刻测得该温度下密闭容器中各物质的物质的量浓度见表
CO2(g)+H2(g)的平衡常数表达式:__________,若某温度时K=1,某时刻测得该温度下密闭容器中各物质的物质的量浓度见表 
此时正、逆反应速率的关系是_________(填序号)。
A.v(正)>v(逆)B.v(正)<v(逆)C.v(正)=v(逆)D.无法确定
Ⅱ.经测定分析某容器内各物质的物质的量浓度(mol/L)变化如表 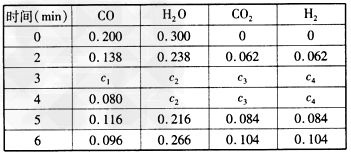
(3)计算出0~3min时CO2的平均反应速率及c4:________、________。
(4)4~5min、5~6min之间可能改变的条件分别是__________(填序号)。
A.使用催化剂、增大CO2浓度 B.升高温度、增大H2O浓度 C.降低温度、减小压强
参考答案:(1)CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
(2)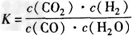 ;A
;A
(3)0.04mol/(L·min);0.12
(4)B
本题解析:
本题难度:一般
3、填空题 (11分)(1)据报道以硼氢化合物NaBH4(H的化合价为-1价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。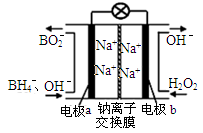
写出该电池放电时负极的电极反应式: 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l) + O2(g) = N2(g)+ 2H2O(l) △H ="
参考答案:
本题解析:
本题难度:困难
4、选择题 曾对化学平衡进行研究并提出平衡移动原理的化学家是( )
A.勒夏特列
B.门捷列夫
C.道尔顿
D.拉瓦锡
参考答案:A
本题解析:
本题难度:简单
5、填空题 (1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析: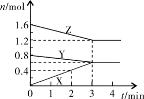
①该反应的化学方程式: ;
②反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
③3min后图中曲线所表示的含义是 。
(2)(4分)下图为石油蒸馏的装置图,根据此图回答下列问题。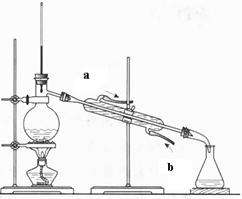
①温度计的水银球插在什么位置?
②蒸馏烧瓶中除了加入石油外还要加入什么?
③冷却水的流动方向如何?(填A或B,下题同)
A、a→b B、 b→a
④得到的汽油、煤油是纯净物吗?
A、是 B、不是
参考答案:(10分)(1)(6分)①Y+2Z 3X ②0.1
3X ②0.1
③在此条件下该反应已达到化学反应限度(或化学平衡)
(2)(4分)①温度计的水银球插在蒸馏烧瓶支管口处
②还要加入沸石或碎瓷片
③B、 ④B、
本题解析:(1)根据图像可知,反应进行到3min时,各种物质的物质的量不再发生变化,说明反应达到平衡状态。此时X增加了0.6mol,Y、Z分别减少0.2mol和0.4mol.应用物质的量的变化量之比是相应的化学计量数之比,因此方程式为Y+2Z 3X。反应开始至2min末,X的物质的量增加了0.4mol,所以其反应速率是
3X。反应开始至2min末,X的物质的量增加了0.4mol,所以其反应速率是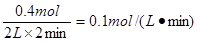 。
。
(2)①蒸馏时温度计测量的是气体的温度,所以温度计的水银球插在蒸馏烧瓶支管口处。
②在加热的条件下,液体容易剧烈跳动,所以需要加入碎瓷片防止暴沸。
③冷凝时水的流向应该和气体的流向相反,所以是b进a出,己答案选B。
④石油的分馏产物仍然是混合物,答案选B。
本题难度:一般