时间:2025-06-26 01:19:55
1、简答题 (12分)硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态。
2SO3(g)达到平衡状态。
①上述反应平衡常数的表达式K=__________
②能判断该反应达到平衡状态的标志是__________。(填字母)
a. SO2和SO3浓度相等? b. SO2百分含量保持不变
c. 容器中气体的压强不变? d. SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率(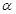 )与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。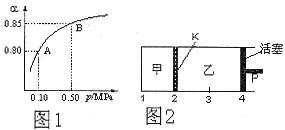
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲__________乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__________填:“增大”、“减小”、“不变”、“无法确定”)
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。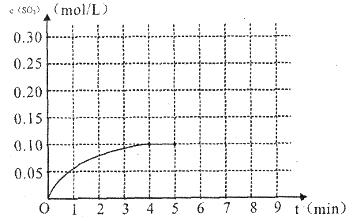
参考答案:(1)①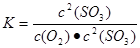 ?②bc
?②bc
(2)=?(3)①小于?②不变?(4)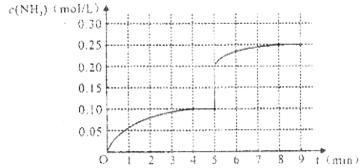
本题解析:(1)①平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该反应的表达式为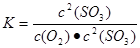 。
。
②在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以b正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,a不正确。反应时体积减小的,因此在反应反应过程中,压强是变化的,c正确。D中反应速率的方向是相同的,是恒成立的,d不正确,答案选bc。
(2)平衡常数只与温度有关系,所以AB两点的平衡常数相等。
(3)①乙的容积和甲相等时,相当于增大乙中压强,所以平衡向正反应方向移动,因此乙中SO2的体积分数大于甲中的。
②由于甲的体积不变,所以其浓度不变,平衡不移动,因此c(SO3)/c(SO2)不变。
在第5分钟将容器的体积缩小一半,则瞬间物质的浓度都是原来的2倍,但平衡向正反应方向移动,所以变化曲线是(见答案)。
本题难度:一般
2、选择题 在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g),下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时2 mol H—O键断裂
参考答案:C
本题解析:对于反应前后气态物质系数不等于零的可逆反应,压强不变的状态即为化学平衡状态,故A正确;
用不同物质表示的正、逆反应速率比等于其方程式中的化学计量系数之比即为化学平衡状态,故B正确;
C项用CO、H2均表示了正向反应速率,而未表示出逆向反应速率,故不能认定该反应是否达平衡状态;
“H—H键断裂”表示v逆(H2),“H—O键断裂”表示v正(H2O)(1mol H2O中有2 molH—O键),且v逆(H2):v正(H2O)=1:1(等于方程式中的化学计量系数之比),故D正确;
本题难度:简单
3、选择题 一定温度下,反应N2(g)+3H2(g)  2NH3(g)达到化学平衡状态的标志是( )
2NH3(g)达到化学平衡状态的标志是( )
A.N2、H2和NH3的质量分数不再改变
B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.N2与H2的物质的量之和是NH3的物质的量的2倍
D.单位时间里每生成1 mol N2,同时消耗2 mol NH3
参考答案:A
本题解析:化学平衡状态的标志实质是v正=v逆≠0,体现在各组分的浓度(或质量分数)不再改变,而与各组分的浓度比例无关。D中,单位时间里每生成1 mol N2,同时生成2 mol NH3,就达到平衡状态。故选A。
点评:本题考查的是化学平衡状态的判断,题目难度中,化学平衡状态的标志实质是v正=v逆≠0,体现在各组分的浓度(或质量分数)不再改变,而与各组分的浓度比例无关。
本题难度:简单
4、选择题 在一定温度下的密闭容器中,加入1mol CO、1 mol H2O发生反应:CO(g)+H2O(g)  CO2(g) +H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
CO2(g) +H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
A.在该温度下平衡常数K=1
B.平衡常数与反应温度无关
C.CO的转化率为50%
D.其他条件不变,改变压强平衡不移动
参考答案:B
本题解析:平衡常数只与反应温度有关。
本题难度:一般
5、填空题 (12分)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(固)
Ca5(PO4)3OH(固) 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿受腐蚀,其原因是?。(3分)
(2)已知Ca(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示:?(3分)
(3)当牙膏中配有氟化物添加剂后能防止龋牙的原因?。(3分)
(4)根据以上原理,请你提出一种其他促进矿化的办法:?。(3分)
参考答案:(1)生成的有机酸,中和OH-,使平衡向脱矿方向移动,加速牙齿腐蚀(2)5Ca2++3PO43-+F-=Ca5(PO4)3F↓(3)使用氟化物,增大了F-的浓度,促进了Ca(PO4)3F的生成。(4)加入Ca2+或PO43-。
本题解析:进食后,细菌和酶作用于食物,产生有机酸,使得Ca5(PO4)3OH固体减小,牙齿受到腐蚀。使用氟化物,增大了F-的浓度,促进了Ca(PO4)3F的生成。促进矿化要使平衡向逆反应方向移动,可以增加生成物的浓度。
本题难度:一般