时间:2025-06-26 00:18:36
1、填空题 甲醇( )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。
(1)利用工业废气中的 可制取甲醇,其反应为:
可制取甲醇,其反应为:
常温常压下已知下列反应的能量变化如图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 的
的  晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为 mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成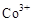 ,然后以
,然后以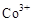 做氧化剂把水中的甲醇氧化成
做氧化剂把水中的甲醇氧化成 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为:
 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L 时,共转移电子 mol。
时,共转移电子 mol。
2、选择题 高铁电池是新型可充电电池,与普通高能电池相比,该电池放电时能长时间保持稳定的电压.高铁电池放电的化学方程式为:
3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述中错误的是( )
A.该反应实现了化学能向电能的转化
B.放电过程中锌元素的化合价降低
C.高铁电池能减少汞等重金属污染
D.放电过程中溶液的pH逐渐升高
3、选择题 下图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述不正确的是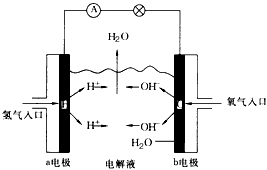
[? ]
A.a电极是负极
B.b电极的电极反应式为:4OH- -4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置
4、选择题 一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料的说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+2e-=2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10+26?e-+13?O2-=4?CO2+5?H2O
5、选择题 爱迪生电池在充电和放电时发生的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
[? ]
① 放电时,Fe参与负极反应,NiO2参与正极反应
② 充电时,阴极上的电极反应式为:Fe(OH)2 + 2e-= Fe + 2OH-
③ 放电时,电解质溶液中的阴离子向正极方向移动
④ 放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A.只有③
B.③④
C.④⑤
D.①②⑤