时间:2025-06-26 00:14:31
1、选择题 某种微粒用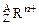 表示,下列
表示,下列 关于该微粒的叙述中正确的是
关于该微粒的叙述中正确的是
A.所含的质子数=A-n
B.所含中子数=A-Z
C.所含的电子数=Z+n
D.质量数=Z+A
2、选择题 下列排列顺序不正确的是
A.熔点:Al>K>Na
B.微粒的半径:Cl- >Na+>Mg2+>Al3+
C.热稳定性:HF>HCl>HBr>HI
D.结合质子能力:AlO-2>CO32->F-
3、填空题 (8分)由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种均为带一个单位正电荷的阳离子或一个单位负电荷的阴离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A++B-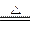 C+D,? B-+E+=2
C+D,? B-+E+=2 D;
D;
②通常情 况下,C是一种无色刺激性气味的气体,且可使湿润的红色石
况下,C是一种无色刺激性气味的气体,且可使湿润的红色石 蕊试纸变蓝;
蕊试纸变蓝;
③向含F离子的溶液中加入C的水溶液,可生成白色沉淀W,C溶液过量沉淀也不消失。再加入含大量B离子或大量E离子的溶液时,沉淀W在其中一种情况下溶解,另一种情况下不溶解。
请回答下列问题:
(1)微粒A的名称及化学式分别为?、?。
(2)C的水溶液中存在的分子总数至少有?种。
(3)写出微粒F与过量C的水溶液反应的离子方程式:?。
(4)向含有0.1mol F离子的50mL溶液中,加入含1.5mol/L B离子的200mL强碱溶液,结果有白色沉淀产生,再向该混合物中加入含1mol/L E离子的强酸溶液,若要使沉淀恰好溶解,则最后加入的溶液的体积至少为?mL。
4、选择题 关于锂的结构和性质判断错误的是
①与水反应比钠剧烈②原子半径小于钠③在空气中燃烧生成氧化锂
④它的阳离子最外层电子数与钠的阳离子相同⑤它是还原剂
A.①④
B.②③
C.③⑤
D.只有①
5、填空题 (9分)
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。

| 实验方案(I) | 实验现象(Ⅱ) | 答案(III) | |
| 实验方案I | 实验现象II | ||
1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 水反应,再向反应液中滴 加酚酞 加酚酞 | A浮与水面,剧烈反应,放出气体, 熔成—个小球,在水面上无定向移 熔成—个小球,在水面上无定向移 动,随之消失,溶液变红色。 动,随之消失,溶液变红色。 | 1 | ? |
2.向新制的H2S饱和溶 液中滴加新制的氯水 液中滴加新制的氯水 | B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 烧,溶液变成浅红色 | 2 | ? |
3.钠与滴有酚酞的冷水反应 | C.反应不十分剧烈,产生的气体 可以在空气中燃烧 可以在空气中燃烧 | 3 | ? |
4.镁带与2mol/L的盐酸 反应 反应 | D.剧烈反应,产生的气体可以在 空气中燃烧 空气中燃烧 | 4 | ? |
5铝条与2mol/L的盐酸 反应 反应 | E.生成白色絮状沉淀,继而沉淀 消失 消失 | 5 | ? |
6.向 溶液中滴加 溶液中滴加  溶液至过量 溶液至过量 | F.生成淡黄色沉淀 | 6 | ? |